题目内容
8.SO2是一种常见的大气污染物,为防止大气污染,某化工厂用石灰乳和O2处理含SO2的尾气,使其转化为石膏(CaSO4•2H2O).每天处理1.12×105L(标准状况下)含SO2的体积分数为5%的尾气,理论上可以得到多少克石膏.(假设在转化过程中硫元素不损失)分析 根据二氧化硫的体积分数计算出二氧化硫的体积,再根据二氧化硫与CaSO4•2H2O的转化关系,由质量守恒计算出石膏(CaSO4•2H2O)的质量.
解答 解:由硫元素质量守恒可知二氧化硫与CaSO4•2H2O的微粒数比为1:1,所以
SO2----------------------------CaSO4•2H2O
22.4L 172g
1.12×105L×5% xg
则x=$\frac{1.12×1{0}^{5}×5%×172}{22.4}$=4300g;
答:理论上可以得到4300克石膏.
点评 本题考查了有关方程式的计算,利用元素守恒计算较简单,题目难度不大,侧重于考查学生的计算能力和分析能力.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
18.下列物质的晶体,按其熔点由高到低的排列顺序正确的是( )
| A. | NaCl SiO2 CO2 | B. | NaCl CO2 SiO2 | ||
| C. | CO2 NaCl SiO2 | D. | SiO2 NaCl CO2 |
19.硅被誉为无机非金属材料的主角,下列物品含二氧化硅的是( )
①陶瓷餐具 ②计算机芯片 ③石英钟表 ④光导纤维 ⑤太阳能电池 ⑥玻璃杯.
①陶瓷餐具 ②计算机芯片 ③石英钟表 ④光导纤维 ⑤太阳能电池 ⑥玻璃杯.
| A. | ①③④ | B. | ②④⑤ | C. | ③④⑥ | D. | ④⑤⑥ |
3.汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ•mol-1,△S=-145J•mol-1•K-1.下列说法中错误的是( )
| A. | 该反应中反应物的总能量高于生成物的总能量 | |
| B. | 该反应常温下不能自发进行,因此需要高温和催化剂 | |
| C. | 该反应常温下能自发进行,高温和催化剂只是加快反应的速率 | |
| D. | 汽车尾气中的这两种气体会与血红蛋白结合而使人中毒 |
13.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 苯酚(C6H5OH)能跟NaOH溶液反应而乙醇不能 | |
| B. | 乙烯能发生加成反应而乙烷不能 | |
| C. | 甲苯能使KMnO4酸性溶液褪色而乙烷不能 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |
20.下列反应中,属于加成反应的是( )
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使溴水褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色变浅 |
17.下列说法中,正确的是( )
| A. | 丙烯的结构简式可以表示为CH3CHCH2 | |
| B. | 用酒精可以将溴水中的溴萃取出来 | |
| C. | 乙烷、乙醇和乙酸都能发生取代反应 | |
| D. | 油脂都不能使酸性高锰酸钾溶液褪色 |
1.下列物质的类别与所含官能团都正确的是( )
| A. | 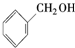 酚类-OH 酚类-OH | B. | 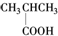 羧酸-COOH 羧酸-COOH | ||
| C. | 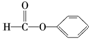 醛类-CHO 醛类-CHO | D. | CH3-O-CH3 醚类-CHO |
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.