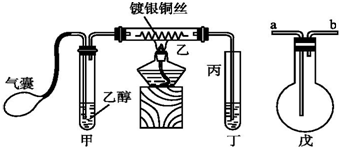
题目内容
13.亚硫酸钠中的硫元素为+4价,请选择下面所提供的化学试剂,设计简单的实验,证明亚硫酸钠既有氧化性,又有还原性.(所提供的试剂为:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、NaOH溶液、氨水)(1)要说明Na2SO3具有氧化性,应选用的试剂是亚硫酸钠溶液、硫化钠溶液、稀硫酸,观察到的现象是产生淡黄色沉淀.
(2)要说明Na2SO3具有还原性,应选用的试剂是溴水,反应的离子方程式是Br2+SO32-+H2O═SO42-+2Br-+2H+,此空多余.
分析 (1)要证明Na2SO3具有氧化性,题中具有强还原性的只有Na2S溶液,可在酸性条件下与亚硫酸钠发生氧化还原反应;
(2)要证明Na2SO3具有还原性,题中只有溴水具有强氧化性,可与亚硫酸钠发生氧化还原反应.
解答 解:(1)要证明Na2SO3具有氧化性,具有强还原性的只有Na2S溶液,可在酸性条件下与亚硫酸钠发生氧化还原反应,则选择试剂为亚硫酸钠溶液、硫化钠溶液、稀硫酸,反应的离子方程式为SO32-+2S2-+6H+=3S↓+3H2O,可观察到溶液中产生淡黄色沉淀,
故答案为:亚硫酸钠溶液、硫化钠溶液、稀硫酸;产生淡黄色沉淀;
(2)要证明Na2SO3具有还原性,题中只有溴水具有强氧化性,则选择的试剂为亚硫酸钠溶液、溴水,二者发生氧化还原反应,可观察到溴水褪色,反应的离子方程式为Br2+SO32-+H2O=2Br-+SO42-+2H+,
故答案为:亚硫酸钠溶液、溴水;Br2+SO32-+H2O=2Br-+SO42-+2H+.
点评 本题考查氧化还原反应知识,侧重于学生的分析能力和元素化合物知识的综合运用,注意把握常见含硫化合物的性质,难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
11.根据磷元素的原子结构示意图(如图所示),做出如下推理,其中与事实不符的是( )
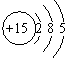
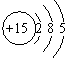
| A. | 磷元素位于元素周期表的第三周期、第ⅤA族 | |
| B. | 磷原子不如氮原子和硫原子的得电子能力强 | |
| C. | 磷的最高价氧化物对应水化物酸性比硫酸强 | |
| D. | 磷的氢化物受热时不如氮的氢化物和硫的氢化物稳定 |
1.下列有关于Cl2的说法中,不正确的是( )
| A. | Cl2是一种黄绿色、密度比空气大的有毒气体 | |
| B. | 红热的铁丝在Cl2中剧烈燃烧,产生白色烟雾 | |
| C. | 工业上用Cl2和石灰乳为原料制造漂白粉 | |
| D. | Cl2能与水反应生成盐酸和次氯酸 |
8.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示.下列说法正确的是( )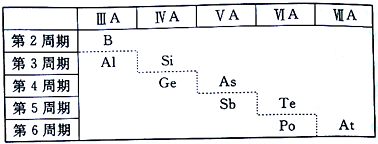

| A. | 虚线右上方的元素为金属元素 | |
| B. | 第6周期ⅤA族的元素为非金属元素 | |
| C. | 可在虚线附近寻找用于制造半导体材料的元素 | |
| D. | 可在虚线附近寻找稀土元素 |
18.下列物质的晶体,按其熔点由高到低的排列顺序正确的是( )
| A. | NaCl SiO2 CO2 | B. | NaCl CO2 SiO2 | ||
| C. | CO2 NaCl SiO2 | D. | SiO2 NaCl CO2 |
5.短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )
| X | ||
| Y | ||
| Z |
| A. | X,Y,Z中X的单质最稳定 | |
| B. | Y的氢化物为HY | |
| C. | Z能生成HZO3 | |
| D. | X、Y、Z三种元素中,非金属性最强的元素Y |
2.欲从苯酚的乙醇溶液中回收苯酚,有下列操作:①蒸馏;②过滤;③分液;④加入足量的金属钠;⑤通入过量的CO2;⑥加入足量的NaOH溶液;⑦加入足量的FeCl3溶液;⑧加入足量浓溴水;⑨加入适量盐酸.合理的步骤是( )
| A. | ④⑤⑨ | B. | ⑥①⑤③ | C. | ⑧②⑦① | D. | ⑦①③④ |
3.汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ•mol-1,△S=-145J•mol-1•K-1.下列说法中错误的是( )
| A. | 该反应中反应物的总能量高于生成物的总能量 | |
| B. | 该反应常温下不能自发进行,因此需要高温和催化剂 | |
| C. | 该反应常温下能自发进行,高温和催化剂只是加快反应的速率 | |
| D. | 汽车尾气中的这两种气体会与血红蛋白结合而使人中毒 |