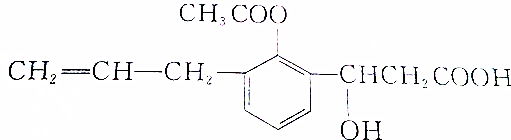
题目内容
18.由两种元素组成的化合物M有如下转化关系: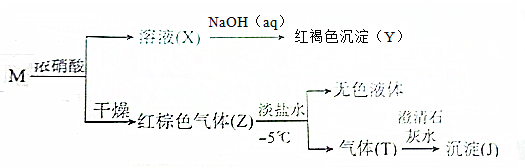
下列推断正确的是( )
| A. | M可能是FeS2、Fe3C、CuS、和Fe3O4 | B. | Y可能是Fe(OH)3、Fe2O3 、Cu2O | ||
| C. | X溶液能溶解铁、铜等金属 | D. | 无色液体可能是N2O4和H2O |
分析 溶液X与氢氧化钠溶液反应得到红褐色沉淀Y,可推知Y为Fe(OH)2,X为铁盐溶液,应为硝酸铁,则M含有Fe元素,M与浓硝酸反应得到X,且干燥得到红棕色气体Z,则Z中含有NO2,故M为还原性物质,由于平衡2NO2?N2O4为放热反应,故Z用淡盐水冷却得到无色液体为N2O4,分离得到气体T能使澄清的石灰水变浑浊,则T为二氧化碳、或二氧化硫,故M中还含有S元素或碳元素,据此解答.
解答 解:溶液X与氢氧化钠溶液反应得到红褐色沉淀Y,可推知Y为Fe(OH)2,X为铁盐溶液,应为硝酸铁,则M含有Fe元素,M与浓硝酸反应得到X,且干燥得到红棕色气体Z,则Z中含有NO2,故M为还原性物质,由于平衡2NO2?N2O4为放热反应,故Z用淡盐水冷却得到无色液体为N2O4,分离得到气体T能使澄清的石灰水变浑浊,则T为二氧化碳、或二氧化硫,故M中还含有S元素或碳元素.
A.由上述分析可知,M具有还原性,且M中含有Fe元素,还含有S元素或碳元素,可能是FeS2、Fe3C,不可能CuS、和Fe3O4,故A错误;
B.溶液X与氢氧化钠溶液反应之间得到红褐色沉淀,故Y是Fe(OH)3,不能为Fe2O3 、Cu2O,故B错误;
C.X为硝酸铁溶液,可以溶解铁、铜等金属,故C正确;
D.M与浓硝酸反应后干燥得到红棕色气体Z,Z冷却分离得到无色液体,不能为H2O,由上述分析论可知,无色液体为N2O4,故D错误,
故选C.
点评 本题考查无机物推断,物质的颜色及现象为推断突破口,注意二氧化氮中存在平衡,难度中等.

练习册系列答案
相关题目
8.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示.下列说法正确的是( )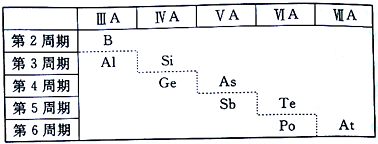

| A. | 虚线右上方的元素为金属元素 | |
| B. | 第6周期ⅤA族的元素为非金属元素 | |
| C. | 可在虚线附近寻找用于制造半导体材料的元素 | |
| D. | 可在虚线附近寻找稀土元素 |
9.下列有关实验的操作或现象描述正确的是( )
| A. | 用浓硫酸可区分蛋白质溶液和淀粉溶液 | |
| B. | 在蛋白质溶液中滴加硫酸铜溶液,生成白色沉淀,加水后,沉淀溶解 | |
| C. | 皂化实验后期加入饱和食盐水使高级脂肪酸盐析出,浮在混合液上面,通过纱布可滤去水层 | |
| D. | 取淀粉水解液,加入新制Cu(OH)2浊液,加热,未见砖红色沉淀生成,说明淀粉尚未水解 |
6.含有碳氢氧三种元素,相对分子质量为60的有机物,当其与钠反应放出氢气时,其结构有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
13.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) $?_{充电}^{放电}$2PbSO4(s)+2H2O(l)市场上一种手提应急灯,主要是“无液干粉”铅蓄电池,其原理是将浓硫酸灌注到硅胶凝胶中去,改善了电池的性能.下列说法不正确的是( )
| A. | 放电时,电子由Pb通过外电路转移到PbO2 | |
| B. | 充电时阴极反应:PbSO4+2e-=Pb(s)+SO42-(aq) | |
| C. | 充电时,电源的正极接铅蓄电池标“-”的一极 | |
| D. | “无液干粉”铅蓄电池中的电解质溶液不易发生泄漏 |
3.汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ•mol-1,△S=-145J•mol-1•K-1.下列说法中错误的是( )
| A. | 该反应中反应物的总能量高于生成物的总能量 | |
| B. | 该反应常温下不能自发进行,因此需要高温和催化剂 | |
| C. | 该反应常温下能自发进行,高温和催化剂只是加快反应的速率 | |
| D. | 汽车尾气中的这两种气体会与血红蛋白结合而使人中毒 |
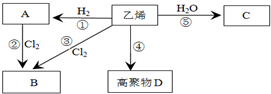 有机物A、B、C、D有如下转化关系.回答下列问题:
有机物A、B、C、D有如下转化关系.回答下列问题: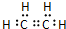 ,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键).
,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键). ,反应类型:加聚反应.
,反应类型:加聚反应.