题目内容
9. 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.请填写下列空白.
(1)E元素基态原子的价层电子排布图为
 .
.(2)B、C、D三种元素的第一电离能数值由小到大的顺序为C<O<N(填元素符号),A和C形成的简单化合物的VSEPR模型为正四面体,空间构型为三角锥形,解释易溶于水的原因NH3与H2O分子之间存在氢键,NH3与H2O都是极性分子,相似相溶原理,NH3易溶于H2O.
(3)B2A4是重要的基本石油化工原料.B2A4分子中B原子轨道的杂化类型为sp2;1mol B2A4分子中含5mol σ键.
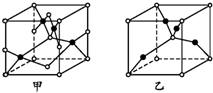
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为CuO,乙为Cu2O;高温时,甲易转化为乙的原因为Cu2O中Cu原子d轨道为全满状态,比较稳定.
分析 A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,则B原子核外有6个电子,故B为碳元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为氧元素;C的原子序数介于碳、氧元素之间,则C为氮元素;E+原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为2+8+18+1=29,则E为Cu元素,据此解答.
解答 解:A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,则B原子核外有6个电子,故B为碳元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为氧元素;C的原子序数介于碳、氧元素之间,则C为氮元素;E+原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为2+8+18+1=29,则E为Cu元素.
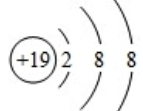
(1)E为Cu元素,基态原子的核外电子排布式为:1s22s22p63s23p63d104s1,价电子排布图为 ,
,
故答案为: ;
;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能数值由小到大的顺序为C<O<N;
A和C形成的简单化合物为NH3,N原子价层电子对数为4,含有1对孤电子对,故VSEPR模型为正四面体,空间构型为三角锥形,NH3与H2O分子之间存在氢键,NH3与H2O都是极性分子,相似相溶原理,NH3易溶于H2O,
故答案为:C<O<N;正四面体;三角锥形;NH3与H2O分子之间存在氢键,NH3与H2O都是极性分子,相似相溶原理,NH3易溶于H2O;
(3)C2H4分子中C原子有3个σ键,无孤电子对,轨道的杂化类型为sp2杂化,1个C2H4分子中含有5个σ键,1个1个π键,lmolC2H4分子中σ键5mol,
故答案为:sp2;5;
(4)已知O、Cu能形成晶胞如图所示的两种化合物,甲中黑色球数目=4,白色球数目=1+2×$\frac{1}{2}$+8×$\frac{1}{8}$+4×$\frac{1}{4}$=4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,乙中黑色球数目=4,白色球数目=1+8×$\frac{1}{8}$=2,黑色球与白色球个数之比为2:1,氧元素为-2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙,
故答案为:CuO;Cu2O;Cu2O中Cu原子d轨道为全满状态,比较稳定.
点评 本题综合考查物质结构与性质,涉及核外电子排布、电离能、价层电子对互斥理论、杂化轨道、分子结构、化学键、晶胞计算等,推断元素是解题关键,(4)中从结构分析氧化铜高温转化为氧化亚铜为易错点、难点,难度中等.

| A. | 植物油和乙醇 | B. | 苯和水 | C. | 酒精和水 | D. | 汽油和煤油 |
| A. | NH3中氮原子为sp2杂化,而CH4中碳原子是sp3杂化 | |
| B. | NH3中N原子形成三个杂化轨道,CH4中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | NH3分子中有三个σ键,而甲烷分子中有四个σ键 |
| A. | 0.2 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.02 mol•L-1 | D. | 0.1 mol•L-1 |
| A. | 氯化钠属于离子化合物,只存在Na+、Cl-的离子形式,不存在NaCl分子 | |
| B. | 化学冰袋(硝酸铵、碳酸钠晶体)冷藏食物利用了其反应和溶解吸热的原理 | |
| C. | 血液透析技术利用了胶体与有害物质微粒直径不同的特点 | |
| D. | 酒精检测仪检测司机是否酒后驾车利用了乙醇的还原性 |
| A. | 在不同温度下,以相同浓度相同体积的Na2S2O3与H2SO4反应来探究温度对化学反应速率的影响: 3S2O32-+2SO42-+10 H+═6SO2↑+2S↓+5 H2O | |
| B. | 已知25℃、101 kPa时,1 mol H2与溴蒸气完全反应生成气态HBr放出能量Q kJ,其热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=-2Q kJ•mol-1 | |
| C. | 表示中和热的热化学方程式:2HCl(aq)+Ba(OH)2(aq)═BaCl2(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| D. | 酸性条件下,KI被O2氧化的离子方程式:4I-+O2+4H+=2I2+2H2O |
| A. | CH2=CH2 | B. | HC≡CH | C. | C2H5OH | D. | 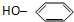 |
 ;
;