题目内容
4.17.1%的蔗糖溶液200g,加适量的水稀释到5L,求稀释后的蔗糖溶液的物质的量浓度(蔗糖相对分子质量为342)( )| A. | 0.2 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.02 mol•L-1 | D. | 0.1 mol•L-1 |
分析 利用m=溶液的质量×质量分数计算出蔗糖的质量,再根据n=$\frac{m}{M}$计算出蔗糖的物质的量,稀释过程中蔗糖的物质的量不变,最后根据c=$\frac{n}{V}$计算出稀释后的蔗糖溶液的物质的量浓度.
解答 解:17%的蔗糖溶液200g,蔗糖的质量为200g×17.1%=34.2g,
则蔗糖的物质的量为:$\frac{34.2g}{342g/mol}$=0.1mol,
加适量的水稀释到5L,稀释过程中蔗糖的物质的量不变,
则稀释后的蔗糖溶液的物质的量浓度为:$\frac{0.1mol}{5L}$=0.02mol/L,
故选C.
点评 本题考查物质的量浓度的计算,题目难度中等,明确质量、物质的量及稀释前后溶质的物质的量不变时解答本题的关键,注意掌握物质的量浓度的概念及计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.可以用分液漏斗进行分离的混合物是( )
| A. | 酒精和碘 | B. | 苯和水 | C. | 乙酸和乙酸乙酯 | D. | 乙酸和水 |
19.在一定温度下,反应H2(g)+Br2(g)?2HBr(g),达到平衡的标志是( )
| A. | 容器里的压强不随时间的变化而改变 | |
| B. | 单位时间内生成2mol HBr的同时,消耗1 mol H2 | |
| C. | 单位时间内生成2mol HBr的同时,生成1 mol H2 | |
| D. | 正反应和逆反应速率都相等,都等于0 |
13.自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,不会产生明显的药品变质问题的是( )
| A. | NaNO3 | B. | FeCl2 | C. | Na2SO3 | D. | NaOH |
14.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Ag2S沉淀溶解电离方程式:Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| C. | Fe3O4与稀硝酸溶液反应:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
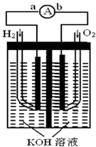 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态. .
.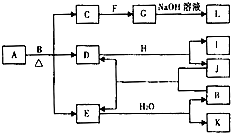 由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:
由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题: