题目内容
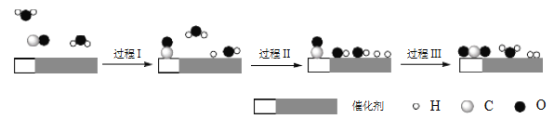
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A. 使用催化剂 B. 适当提高氧气的浓度
C. 适当提高反应的温度 D. 适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
(资料)①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
化学键 | H—H | O=O | H—O |
键能 | 436 | 496 | 463 |
请填写表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化 | |
拆开化学键 |
| ______ | ____ |
| ______ | ____ | |
形成化学键 |
| ______ | ____ |
总能量变化 | ______ | ____ | |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
【答案】ABC A 吸收热量 872 吸收热量 496 放出热量 1852 放出热量 484 负 氧化 2.24
【解析】
(1)常用的加快化学反应速率的方法是:升高温度,加入正催化剂,增大反应物浓度,增大压强(浓度也增大)等,故选ABC;
(2)反应物的总能量高于生成物的总能量,称为放热反应。氢气的燃烧反应属于典型的放热反应,所以能正确表示反应能量变化的是A;
(3)拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。反应物化学键断裂,吸收能量,生成物形成化学键,释放能量,吸收的总能量减去释放的总能量为该反应的能量变化,若为负值,则为放热反应,反之为吸热反应。则拆开![]() 中的化学键436×2=872
中的化学键436×2=872![]() ,拆开
,拆开![]() 中的化学键496
中的化学键496![]() ,共吸收1368
,共吸收1368![]() ,形成
,形成![]() 键,放出463×4=1852
键,放出463×4=1852![]() ,反应的总能量变化为放出484
,反应的总能量变化为放出484![]() ;
;
(4)氢氧燃料电池中,氢气作负极反应物发生氧化反应,氧气作正极反应物发生还原反应,根据反应式,每有2molH2参与反应,转移电子4mol电子,故每转移0.2mol电子,参与反应的氢气为0.1mol H2,标准状况下2.24L。

 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】在一定温度下,将气体0.22 mol X和气体0.16 mol Y充入5 L恒容密闭容器中,发生反应2X(g) + Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A. 该温度下此反应的平衡常数K = 72.0 L/mol
B. 反应前2 min的平均速率υ(Z) = 4.0×10-3 mol/(L·min)
C. 其他条件不变,降低温度,反应达到新平衡前υ(逆) > υ(正)
D. 其他条件不变,再充入0.1 mo1 X,新平衡时X的转化率将增大