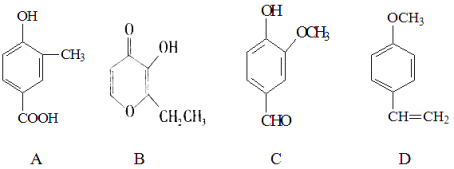
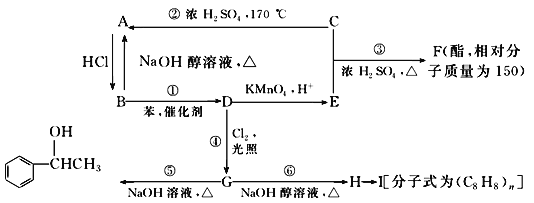
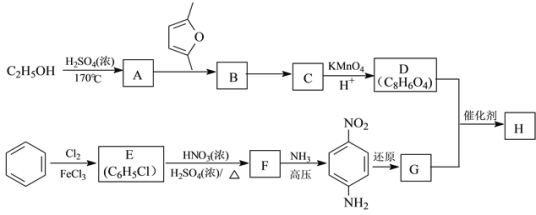
题目内容
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4LO2含有的原子数为NA
B.23 g钠与O2完全反应时失去电子数目为2NA
C.标准状况下,18gH2O中含有的分子数为NA
D.标准状况下,11.2LCO2含NA个CO2分子
【答案】C
【解析】
A、标准状况下,22.4LO2的物质的量为1mol,故所含原子数为2NA,故A错误;
B、23 g钠的物质的量为![]() =1mol,在与O2反应的过程中,只有Na化合价升高,其化合价从0价升高至+1价,故转移电子数为NA,故B错误;
=1mol,在与O2反应的过程中,只有Na化合价升高,其化合价从0价升高至+1价,故转移电子数为NA,故B错误;
C、18gH2O的物质的量为![]() =1mol,其分子数为NA,故C正确;
=1mol,其分子数为NA,故C正确;
D、标准状况下,11.2LCO2的物质的量为![]() =0.5mol,所含分子数为0.5NA,故D错误;
=0.5mol,所含分子数为0.5NA,故D错误;
故答案为C。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如图:
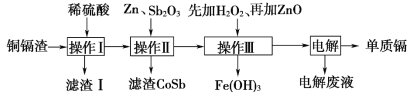
表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)酸浸时粉碎铜镉渣的目的是___。
(2)操作Ⅰ产生的滤渣主要成分为__(填化学式)。
(3)①操作Ⅲ中先加入适量H2O2,发生反应的离子方程式为__。
②再加入ZnO控制反应液的pH,pH范围为__,判断依据是__。
③若加入的H2O2不足,加入ZnO后所得的电解液中会含有Fe元素。请设计实验方案加以鉴别:__。
(4)处理含镉废水常用加入碳酸钙实现沉淀转化,该沉淀转化的反应方程式为___。除去工业废水中的Cd2+时,若反应达到平衡后溶液中c(Ca2+)=0.1mol·L-1,溶液中c(Cd2+)=__mol·L-1[已知25℃,Ksp(CdCO3)=5.6×10-12,Ksp(CaCO3)=2.8×10-9]。