题目内容
【题目】某“84”消毒液部分标签如下图所示,回答下列问题:
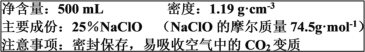
(1)NaClO变质的反应属于__________(填“氧化还原反应”或“非氧化还原反应”)
(2)计算该“84”消毒液的物质的量浓度________mol·L-1(保留小数点后一位)。
(3)某实验需用480 mL 2.0 mol·L-1NaClO的消毒液,现用NaClO固体配制。
a.需要用托盘天平称量NaClO的固体质量为________g
b.配制时,一般可分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却
正确的操作顺序为:____________________________________(填序号)
(4)在配制过程中,除需要烧杯、托盘天平外还必需的仪器有______________(写两种)
(5)下列操作可能使配制溶液浓度偏低的是________
A.移液时,未洗涤烧杯内壁和玻璃棒 B.溶解后未经冷却就移液
C.移液时,有少量液体溅出 D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
【答案】非氧化还原反应 4.0 74.5 ②①③⑧⑤⑥⑦④ 500mL容量瓶、胶头滴管、玻璃棒 AC
【解析】
(1)根据氧化还原反应特征进行分析;
(2)根据c=![]() 进行计算;
进行计算;
(3)配制480mL溶液需使用500mL容量瓶,根据m=cVM进行计算;配制具体操作一般为:计算→称量→溶解→冷却→移液→洗涤→定容→摇匀,据此进行分析;
(4)在配制一定物质的量浓度的溶液操作过程中,必须的仪器为:烧杯、托盘天平、500 mL 容量瓶、胶头滴管、玻璃棒,据此进行分析;
(5)根据c=![]() 进行分析。
进行分析。
(1)NaClO吸收CO2变质过程为:NaClO+CO2+H2O=HClO+NaHCO3,该过程中元素化合价均未发生变化,属于非氧化还原反应;
故答案为:非氧化还原反应;
(2)“84”消毒液的物质的量浓度=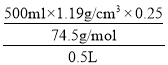 =4mol/L;
=4mol/L;
故答案为:4;
(3)配制480mL溶液需使用500mL容量瓶,因此需要称取NaClO的质量为:0.5L×2mol/L×74.5g/mol=74.5g;配制具体操作一般为:计算→称量→溶解→冷却→移液→洗涤→定容→摇匀;
故答案为:74.5;②①③⑧⑤⑥⑦④;
(4)在配制过程中,必须的仪器为:烧杯、托盘天平、500 mL 容量瓶、胶头滴管、玻璃棒;
故答案为:500 mL 容量瓶、胶头滴管、玻璃棒;
(5)A.移液时,未洗涤烧杯内壁和玻璃棒,会导致溶质未完全转移,n偏低,所配制溶液浓度偏低,故A符合题意;
B.溶解后未经冷却就移液,待溶液冷却后,溶液体积将会减小,V偏小,所配制溶液浓度偏高,故B不符合题意;
C.移液时,有少量液体溅出,会导致溶质有损失,n偏低,所配制溶液浓度偏低,故C符合题意;
D.定容时,俯视刻度线,会导致溶液实际体积偏小,所配制溶液浓度偏高,故D不符合题意;
E.容量瓶用蒸馏水洗净后,没烘干就直接使用,因定容过程中需要加入蒸馏水,因此不会影响溶液浓度,故E不符合题意;
故答案为:AC。

 阅读快车系列答案
阅读快车系列答案