题目内容
【题目】锌铜原电池(如图)工作时,下列叙述正确的是( )
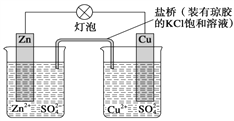
A. 正极反应为Zn-2e-==Zn2+
B. 电池反应为Zn+Cu2+==Zn2++Cu
C. 盐桥中的K+移向ZnSO4溶液
D. 在外电路中,电流从负极流向正极
【答案】B
【解析】A、该装置是原电池,较不活泼的金属铜作正极,正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,选项A错误;B、该原电池中,负极上锌失电子发生氧化反应,正极上铜离子得电子发生还原反应,所以电池反应式为:Zn+Cu2+=Zn2++Cu,选项B正确;C、该原电池放电时,盐桥中阳离子向正极移动,所以K+移向CuSO4溶液,选项C错误;D、原电池放电时,在外电路中电子从负极沿导线流向正极,选项D错误;答案选B。

练习册系列答案
相关题目