题目内容
【题目】(1)已知:H2(g)+O2(g)H2O(g),反应过程中能量变化如图所示,则:
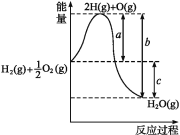
①a、b、c分别代表什么意义?a_;b_;c_。
②该反应是_反应(填“吸热”或“放热”),ΔH_0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是__________。(请写两条)
(3)已知:H2(g)+O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)H2(l) ΔH=-0.92 kJ·mol-1
O2(g)O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:________________
【答案】1 mol H2分裂为H、0.5 mol O2分裂为O时吸收的热量H、O结合生成1 mol H2O(g)放出的热量1 mol H2和0.5 mol O2生成1 mol H2O(g)时,反应放出的热量放热<相同质量时,氢气放出的热量多,产物为水,无污染H2(l)+O2(l)H2O(g) ΔH=-237.46 kJ·mol-1
【解析】
(1)①依据化学反应的反应热可以根据反应的实质分析,断裂化学键吸收能量,生成化学键放出能量,二者的差值是反应的反应热;②依据反应物和生成物的能量高低和反应的能量守恒分析判断;(2)根据氢气燃烧的原理、氢气作为能源的优点分析;(3)据盖斯定律解答。
(1)①图象中可以分析判断,a代表旧键断裂吸收的能量;c为反应生成化学键放出的热量减去反应断裂化学键吸收的热量,即c代表反应热;
故答案为:a1 mol H2分裂为H、0.5 mol O2分裂为O时吸收的热量;H、O结合生成1 mol H2O(g)放出的热量;1 mol H2和0.5 mol O2生成1 mol H2O(g)时,反应放出的热量;
②反应物的能量高于生成物的能量,依据化学反应的能量守恒,反应是放热反应,焓变小于0,故答案为:放热;<;
(2)氢气在氧气中可以燃烧可以放出大量的热,氢气的燃烧产物是水,不污染环境,故答案为:放热量高;无污染;
(3)已知:①2H2(g)+O2(g)═2H2O(l)△H=-285.8kJmol-1
②H2(g)═H2(l)△H=-0.92kJmol-1
③O2(g)═O2(l)△H=-6.84kJmol-1
④H2O(l)═H2O(g)△H=+44.0kJmol-1
据盖斯定律,①-②×2-③+④×2得:2H2(l)+O2(l)=2H2O(g)△H=-191.12kJ/mol。

 名校课堂系列答案
名校课堂系列答案【题目】氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:

回答下列问题:
(1)仪器E的名称是_____________;其作用是_______________________________________。
(2)装置B中的溶液为___________________。
(3)用恒压滴液漏斗代替分液漏斗的优点是__________________________________________。
(4)装置A中反应的离子方程式为__________________________________________________。
(5)反应结束后,关闭K1和K2,打开K3,加热三颈烧瓶,分馏出氯化苄,应选择温度范围为______℃。
物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
(6)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL 4 molL-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为_____%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是__________________________________________________。
【题目】在一个固定体积的密闭容器内,保持一定的温度发生以下反应:H2+Br22HBr.已知加入1molH2和2molBr2 时,达到平衡状态生成a molHBr.在相同条件下,且保持平衡时的各物质的百分含量相同,则填写下列空白:
编号 | 起始状态(mol) | 平衡时HBr 物质的量(mol) | ||
H2 | Br2 | HBr | ||
已知 | 1 | 2 | 0 | a |
① | 2 | 4 | 0 | _____ |
② | _____ | _____ | 1 | 0.5a |
③ | m | n(n≥2m) | _____ | _____ |