题目内容
20.氢原子的电子云图中的小黑点表示的意义是( )| A. | 一个小黑点表示一个电子 | B. | 表示电子运动的轨迹 | ||
| C. | 电子在核外空间出现机会的多少 | D. | 黑点的多少表示电子个数的多少 |
分析 氢原子的电子云图中的小黑点表示电子在核外空间出现机会的多少,以此来解答.
解答 解:氢原子的电子云图中的小黑点表示电子在核外空间出现机会的多少,而不表示具体的原子、原子的个数及电子的运动轨迹,电子运动无轨迹,故选C.
点评 本题考查原子核外电子的运动,注意运动无规律,只能利用出现的机会(或概率)来描述电子运动情况,题目难度不大.

练习册系列答案
相关题目
11.甲乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.
| A. | ①②③ | B. | 只有⑤ | C. | ①②③④⑤ | D. | ①② |
8.下列说法中正确的是( )
| A. | 因为3O2═2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 | |
| B. | H2O(g)→H2O(l)的过程放出大量的热,所以该过程是化学变化 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 1 mol/L的稀H2SO4溶液与1 mol/L的稀Ba(OH)2溶液完全反应所放出的热量就是该反应的中和热 |
15.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中不正确的是( )
| A. | 原子半径:X>Y>Z | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物稳定性:X>Y>Z | D. | 原子序数:X>Y>Z |
5.按所示格式填写下表:
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 8 | 1s22s22p4 | 2s22p4 | 第二周期 | ⅥA |
| 24 | 1s22s22p63s23p63d54s1 | 3d54s1 | 第四周期 | ⅥB |
12.现有三种元素的基态原子的电子排布式如下:
①3s23p4;②1s22s22p63s23p3;③1s22s22p5.则上述三种原子的第一电离能大小关系正确的是( )
①3s23p4;②1s22s22p63s23p3;③1s22s22p5.则上述三种原子的第一电离能大小关系正确的是( )
| A. | ②>①>③ | B. | ③>①>② | C. | ③>②>① | D. | ①>②>③ |
9.能发生消去反应,且生成物中存在同分异构体的是( )
| A. | 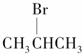 | B. |  | C. |  | D. | CH3Cl |
10.草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
【实验一】根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸受热分解的产物中含有CO2和CO(部分夹持仪器和加热装置省略).
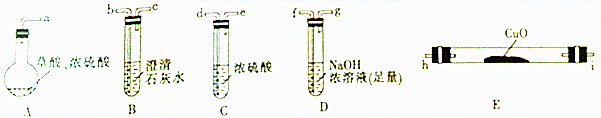
(1)用字母表示接口的正确连接顺序:a→b→c→f→g→d→e→h→i→b→c(部分装置可重复使用).
(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
(3)利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”或“E”,下同)装置,后加热E装置.
【实验二】利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案.
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5(或5:2).
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
【实验三】H2C2O4溶液浓度的测定.
某同学取一定量草酸晶体配置成100mL溶液,取25.00mL溶液于锥形瓶中,然后用0.10mol•L-1的KMnO4标准溶液滴定该溶液,到达滴定终点时共消耗KMnO4标准溶液24.00mL.
(5)①KMnO4标准溶液应用酸式(填“酸式”或“碱式”)滴定管盛装,滴定终点时的现象是溶液变为紫红色且30s内不变色.
②该同学配制的H2C2O4溶液的物质的量浓度为0.24mol•L-1.
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O.草酸钙和草酸氢钙均为白色不溶物 |

(1)用字母表示接口的正确连接顺序:a→b→c→f→g→d→e→h→i→b→c(部分装置可重复使用).
(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
(3)利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”或“E”,下同)装置,后加热E装置.
【实验二】利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案.
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
【实验三】H2C2O4溶液浓度的测定.
某同学取一定量草酸晶体配置成100mL溶液,取25.00mL溶液于锥形瓶中,然后用0.10mol•L-1的KMnO4标准溶液滴定该溶液,到达滴定终点时共消耗KMnO4标准溶液24.00mL.
(5)①KMnO4标准溶液应用酸式(填“酸式”或“碱式”)滴定管盛装,滴定终点时的现象是溶液变为紫红色且30s内不变色.
②该同学配制的H2C2O4溶液的物质的量浓度为0.24mol•L-1.
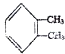 ;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为
;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为 或
或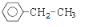 .
.