题目内容
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子。为确定溶液X的成分,进行如下实验: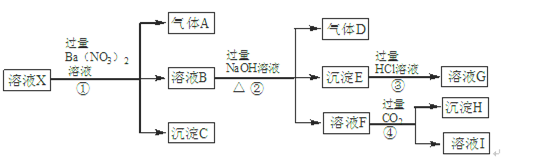
根据以上信息,请回答下列问题:
(1)溶液X中肯定不含有的离子是 ,不能确定是否含有的离子是 ,若要确定是否含有这种离子,最可靠方法是:
。
(2)溶液I中所含溶质有 (填化学式)。
(3)步骤①②③④中,发生符合“强酸制弱酸”反应的步骤是 (填序号)。
(4)步骤①中生成气体A的离子方程式是 。
(1)Ba2+、CO32-、SiO32-、NO3- (每个1分,共4分) Fe3+(1分)
取少量X溶液于试管中,在其中滴加几滴KSCN溶液,若溶液不显血红色则说明没有Fe3+,若显血红色则说明含有Fe3+(2分)
(2)NaNO3、NaHCO3、Ba(NO3)2 (CO2、H2CO3不作要求)(每个1分,共3分)
(3)④(1分) (4)3Fe2++NO3- +4H+=3Fe3++NO↑+2H2O (2分)
解析试题分析:(1)题干中强酸性溶液中一定不含CO32-、SiO32-;NO3-与Fe2+不能同时存在;根据转化关系中X溶液中加入过量硝酸钡生成气体沉淀和溶液的反应,依据离子性质推断溶液中一定含Fe2+,一定不含NO3?;酸性溶液中硝酸根离子具有强氧化性,加入Ba(NO3)2后得到气体A为NO,D为NO2;沉淀C为硫酸钡,判断溶液中一定含SO42-;根据离子共存判断原溶液中一定不含Ba2+;溶液B中一定含有Fe3+;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+;生成的沉淀E是Fe(OH)3;与碱反应生成的气体D为NH3;溶液F通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-;证明原溶液中一定含有Al3+;沉淀H为Al(OH)3;原溶液中一定含有Al3+、NH4+、Fe2+、SO42-;一定不含Ba2+、CO32-、SiO32-、NO3-;可能含有的Fe3+;用KSCN溶液可检验是否含有Fe3+。
(2)溶液F加入过量的CO2得到的溶液I,一定含有生成的NaHCO3、第①②步剩余和生成的NaNO3和Ba(NO3)2。
(3)①为Ba2+与SO42?反应、NO3?和H+氧化Fe2+;②NaOH与NH4+和Fe3+反应;③为Fe(OH)3与HCl的反应;④为CO2、H2O与AlO2-生成Al(OH)3的反应,所以符合“强酸制弱酸”反应为④。
(4)步骤①中生成气体A为NO3?、H+氧化Fe2+,配平可得离子方程式:)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 。
考点:本题考查离子的推断、离子方程式的书写。

 阅读快车系列答案
阅读快车系列答案硅孔雀石是一种含铜的矿石,含铜形态为
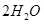 ,同时含有
,同时含有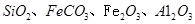 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图: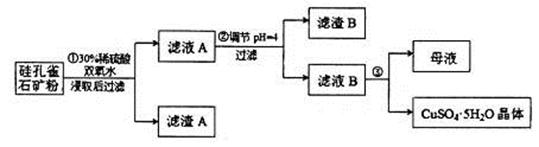
请回答下列问题:
(1)完成步骤①中稀硫酸与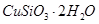 发生反应的化学方程式
发生反应的化学方程式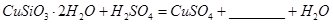 ;
;
用离子方程式表示双氧水的作用_____________________________。
(2)步骤②调节溶液pH选用的最佳试剂是__________________
A.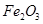 | B.CuO | C.A12O3 | D.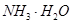 |
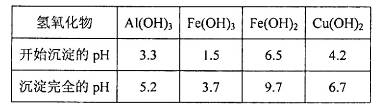
由上表可知:当溶液pH=4时,可以完全除去的离子是______,不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到
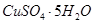 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,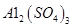 饱和溶液中
饱和溶液中 mol
mol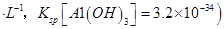 ______________。
______________。(5)若要测定硫酸铜晶体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、 “偏低”或“不变”)。