题目内容
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)写出亚硝酸的电离方程式: 。
(2)在酸性条件下,当NaNO2与KI按物质的量之比1∶1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为 (填化学式)。
(3)要得到稳定的HNO2溶液,可以向冷冻的NaNO2浓溶液中加入或通入某种物质,下列物质不适合的是 (填字母)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸
(4)碱性工业废水中的N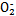 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
①写出上述反应的离子方程式: 。
②发生上述反应后废水的pH将 (填“增大”“减小”或“不变”)。
(5)酸性工业废水中的N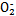 可用尿素除去。尿素
可用尿素除去。尿素
(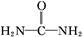 )与N
)与N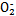 在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
(1)HNO2 H++N
H++N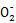 (2)NO (3)bc
(2)NO (3)bc
(4)①2Al+N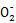 +OH-+2H2O
+OH-+2H2O 2Al
2Al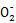 +NH3·H2O ②减小
+NH3·H2O ②减小
(5)15
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。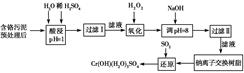
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 11.1 | 8 | 9(>9溶液) |
(1)酸浸时,为了提高浸取率可采取的措施为________________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+,下同)。
(3)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是________。
(4)试配平反应方程式:

 ;
;生成1 mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解