题目内容
全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:①
(写出离子方程式);②Br2+3CO32—=BrO3—+ 5Br—+3CO2↑;③BrO3—+ 5Br—+6H+=3Br2+3H2O。其中反应②中氧化剂是 ;还原剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,
然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫的离子反应方程式:_ 。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 。下列可以用于海水中溴的萃取试剂的 。
①乙醇 ②四氯化碳 ③硝酸 ④裂化汽油
(1)Cl2+2Br-=2Cl-+Br2 ;Br2;Br2(2)Br2+SO2+2H2O=2HBr+H2SO4;(3)分液漏斗 ②
解析试题分析:(1)氯气具有强氧化性,能把溴离子氧化生成单质溴,反应的离子方程式为Cl2+2Br-=2Cl-+Br2;根据反应式Br2+3CO32—=BrO3—+ 5Br—+3CO2↑可知,反应中溴元素的化合价部分从0价升高到+5价,失去5个电子。部分从0价降低到-1价,得到1个电子,所以电子溴既是氧化剂,也是还原剂。
(2)单质溴具有氧化性,能把SO2氧化生成硫酸,反应的化学方程式我Br2+SO2+2H2O=2HBr+H2SO4。(3)实验室中萃取用到的实验仪器名称是分液漏斗。由于萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,选用的萃取剂的原则是:①和原溶液中的溶剂互不相溶更不能发生化学反应;②溶质在该溶剂中溶解度要远大于原溶剂,据此可以判断。乙醇与水互溶,不能作为萃取剂,①不正确;单质溴易溶在四氯化碳中,且四氯化碳不溶于水,可以作为萃取剂,②正确;硝酸与水互溶,不能作为萃取剂,③不正确;裂化汽油中含有不饱和烃,能和溴水发生加成反应,不能作为萃取剂,④不正确,答案选②。
考点:考查从海水萃取溴的实验判断、氧化还原反应以及萃取的有关判断

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
 、
、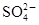 。为了进一步确认,取样进行实验检测:
。为了进一步确认,取样进行实验检测: