题目内容
【题目】铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( ) 
A.阳极电极方程式为Al﹣3e+6OH﹣=Al2O3+3H2O
B.随着电解的进行,溶液的pH逐渐增大
C.当阴极生成气体3.36L(标况)时,阳极增重2.4g
D.电解过程中H+移向Al电极
【答案】C
【解析】解:A、电解质为硫酸溶液,氢氧根离子不可能参加反应,阳极反应为:Al﹣3e﹣=3Al3+,故A错误;
B、根据原电池装置和题目信息可知电解总反应为:2Al+3H2O ![]() Al2O3+3H2↑,水减少,溶液的pH逐渐减小,故B错误;
Al2O3+3H2↑,水减少,溶液的pH逐渐减小,故B错误;
C、阴极反应为:2H+﹣2e﹣=H2↑,氢气的物质的量为: ![]() =0.15mol,则转移的电子的物质的量为:2×0.15mol=0.3mol,阳极反应为:2Al+3H2O﹣6e﹣=Al2O3+6H+;根据质量差法进行计算:设阳极增重的质量为x,
=0.15mol,则转移的电子的物质的量为:2×0.15mol=0.3mol,阳极反应为:2Al+3H2O﹣6e﹣=Al2O3+6H+;根据质量差法进行计算:设阳极增重的质量为x,
2Al+3H2O﹣ | 6e﹣=Al2O3 +6H+ | △m |
6mol | 48g | |
0.3mol | x |
6mol:0.3mol=48g:x,
解得x=2.4g,即阳极增重2.4g,故C正确;
D、根据电流方向可知,阳离子向着阴极移动,铝为阳极,石墨为阴极,所以氢离子向着石墨移动,故D错误;
故选C.

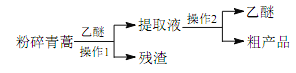
【题目】实验室制备1,2-二溴乙烷的反应原理如下所示:
第一步:CH3CH2OH ![]() CH2=CH2+H2O;
CH2=CH2+H2O;
第二步:乙烯与溴水反应得到1,2-二溴乙烷。
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):
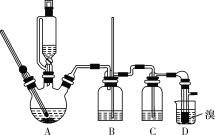
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点/(℃) | 78.5 | 132 | 34.6 |
熔点/(℃) | -130 | 9 | -116 |
请回答下列问题:
(1)写出乙烯与溴水反应的化学方程式:___________________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是___________(填字母代号)。
a.引发反应 b.加快反应速率
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是__________________。
(4)在装置C中应加入_________(填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________(填“上”或“下”)层。
(6)若产物中有少量未反应的Br2,最好用________(填字母代号)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用__________的方法除去。
(8)判断该制备反应已经结束的最简单方法是___________________________。