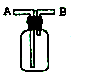题目内容
【题目】如图是Zn和Cu形成的原电池,回答下列问题:
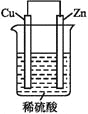
(1)正极发生____反应(选填“氧化”或“还原”),负极电极反应式为:____。
(2)电子流动方向,从____电极(选填“Cu”或“Zn”),经外电路,流向另一电极。阳离子向____电极定向移动(选填“Cu”或“Zn”)。
(3)有0.1 mol电子流过导线,则产生H2在标准状况下的体积为____,若是断开Zn和Cu之间的导线,产生气泡的速度____(选填“加快”、“不变”或“减慢”)。
【答案】(1)还原;Zn-2e-=Zn2+;(2)Zn;Cu;(3)1.12 L;减慢。
【解析】试题分析:(1)根据原电池的构成条件,Zn作负极,Cu作正极,根据原电池的工作原理,正极电极反应式为2H++2e-=H2↑,得到电子被还原,发生还原反应,负极电极反应式为:Zn-2e-=Zn2+;(2)根据原电池的工作原理,电子从负极经外电路流向正极,阳离子从负极流向正极,负极为锌,正极为铜,因此电子:锌→外电路→铜,阳离子从锌流向铜;(3)2H++2e-=H2↑,通过0.1mol电子产生V(H2)=0.1×22.4/2L=1.12L,原电池加快反应速率,断开导线,不在是原电池,则化学反应速率减缓。

练习册系列答案
相关题目