题目内容
【题目】硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化
物。某化学研究小组利用下列装置加热至高温使FeSO4分解。
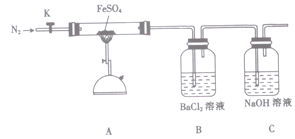
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却。
(2)已知M中铁元素的质量分数为70%,M的化学式为__________。
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验。

(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A →________ →________。
②能证明生成了非金属氧化物N的现象是________________。
【答案】(1)Fe2O3;
(2)①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;
③有红棕色固体物质生成;④2FeSO4![]() Fe2O3+SO2↑+ SO3↑;
Fe2O3+SO2↑+ SO3↑;
(3)①F;②F中品红溶液褪色。
【解析】
试题分析:(1)已知M中铁元素的质量分数为70%,则M中Fe和O的原子个数之比为![]() ,所以M的化学式为Fe2O3;
,所以M的化学式为Fe2O3;
(2)硫酸亚铁高温分解生成氧化铁,这说明发生了氧化还原反应,所以反应中有SO2和SO3生成,SO3通入氯化钡溶液中生成硫酸钡沉淀,所以B中的实验现象是产生白色沉淀,反应的方程式为SO3+H2O+BaCl2=BaSO4↓+2HCl;反应中有氧化铁生成,所以硬质玻璃管中有红棕色固体物质生成,反应的方程式为2FeSO4![]() Fe2O3+SO2↑+ SO3↑。
Fe2O3+SO2↑+ SO3↑。
(3)SO2能使品红溶液褪色,则检验SO2可以用品红溶液,即F中品红溶液褪色证明生成了非金属氧化物SO2。