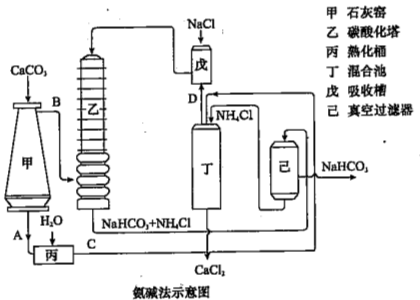
题目内容
【题目】A、B、C、D为短周期元素,A的M电子层有1个电子,B的最外层电子数为内层电子数的2倍,C的最高化合价为最低化合价绝对值的3倍,C与D同周期,D的原子半径小于C。
(1)B位于元素周期表第____周期第____族。
(2)C2-离子的结构示意图为____。A+、C2-、D-中离子半径最小的是____。(用具体离子符号表示)
(3)BC2与二氧化碳的结构相似,其结构式为____。A2C的电子式为____。
(4)A、D元素最高价氧化物对应水化物相互反应的化学方程式为____。
【答案】(1)2;ⅣA;(2)![]() ;Na+;(3)S=C=S;
;Na+;(3)S=C=S;![]() ;(4)NaOH+HClO4=NaClO4+H2O。
;(4)NaOH+HClO4=NaClO4+H2O。
【解析】试题分析:A的M层上1个电子,推出M为Na,B的最外层电子数为内层电子数的2倍,应位于第二周期,即B为C,C的最高化合价为最低化合价绝对值的3倍,应是VIA族元素,则C为S,D和S属于同周期,且D的原子半径小于S,则D为Cl,(1)C位于第二周期第IVA族;(2)S2-的结构示意图为![]() ;电子层越多,半径越大,电子层数相同,半径随原子序数的递增而减小,因此有S2->Cl->Na+,半径最小的是Na+;(3)BC2的分子式为CS2,CO2的结构式为O=C=O,两者结构相似,则CS2的结构式为S=C=S,A2C的分子式为Na2S,属于离子化合物,电子式类似Na2O,则Na2S的电子式为:
;电子层越多,半径越大,电子层数相同,半径随原子序数的递增而减小,因此有S2->Cl->Na+,半径最小的是Na+;(3)BC2的分子式为CS2,CO2的结构式为O=C=O,两者结构相似,则CS2的结构式为S=C=S,A2C的分子式为Na2S,属于离子化合物,电子式类似Na2O,则Na2S的电子式为:![]() ;(4)最高价氧化物对应水化物分别是NaOH、HClO4,发生中和反应,NaOH+HClO4=NaClO4+H2O。
;(4)最高价氧化物对应水化物分别是NaOH、HClO4,发生中和反应,NaOH+HClO4=NaClO4+H2O。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目