��Ŀ����
����Ŀ����1����̬ͭԭ�ӵĺ���δ�ɶԵ�����ĿΪ___________��
��2�����ݵ�2����Ԫ�ص�һ�����ܵı仯���ɣ�������ͼB��FԪ�ص�λ�ã���С�ڵ���C��N��O����Ԫ�ص����λ�á�

��3��NF3����NH3��F2��Cu���������·�Ӧֱ�ӵõ���
2NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
������ѧ����ʽ�е�5�����������ľ���������___________��
��4��BF3��һ����ˮ�γɣ�H2O��2BF3����Q��Q��һ�������¿�ת��ΪR:
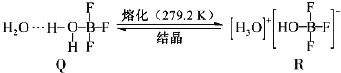
������Q�и��������ǿ�����������___________������ţ���
a�����Ӽ� b�����ۼ� c����λ�� d�������� e����� f�����»���
��R�������ӵĿռ乹��Ϊ___________�������ӵ�����ԭ�ӹ������1��2sԭ�ӹ����___________��___________ԭ�ӹ���ӻ���
��5����ͭ�ۼ���Ũ��ˮ��.��ͨ����������ַ�Ӧ����Һ�����ɫ��һ��ͭ���ӵ���λ�����.
�÷�Ӧ�����ӷ���ʽΪ___________��
��6��������Ϊ�������������ṹ�����ͣ�.�����е���λ��Ϊ___________����������ܶ�Ϊ��g/cm3����ԭ�Ӱ뾶Ϊ___________cm���ú�����NA�Ĵ���ʽ��ʾ�����ػ���
���𰸡���1��1��
��2��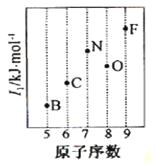
��3�����Ӿ��塢���Ӿ��塢��������
��4����bc�� ��������3��2p
��5��2Cu+8 NH3H2O+O2=2[Cu��NH3��4]2++4OH-+6H2O
��6��8��![]() ��
��![]()
�������������������1��Cuԭ�Ӻ�����29�����ӣ���̬ͭԭ�ӵĺ�������Ų�ʽΪ��1s22s22p63s23p63d104s1��δ�ɶԵ�����ĿΪ1�ʴ�Ϊ��1��
��2��ͬ�����������Ԫ�صĵ�һ�����ܳ��������ƣ�����Ԫ�ص�2p�ܼ�����3�����ӣ����ڰ����ȶ�״̬���������ͣ���Ԫ�صĵ�һ�����ܸ���ͬ��������Ԫ�أ���C��N��O����Ԫ�ص����λ��Ϊ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3��Cu�ǽ��������ڽ������壬NH4F���Σ��������Ӿ��壬NH3��F2��NF3�����ڷ��Ӿ��壬�ʴ�Ϊ�����Ӿ��塢���Ӿ��塢�������壻
��4������Q�Ľṹ��֪��Q�����д�������������ۼ�����λ����O��B֮�䣩�����Ӽ�������������ǿ����������й��ۼ�����λ�����ʴ�Ϊ��bc��
��R��������ΪH3O+������ԭ����ԭ�Ӽ۲���Ӷ���=3+![]() ����61��31��=4���µ��Ӷ�=
����61��31��=4���µ��Ӷ�=![]() ����61��31��=1��Ϊ�����ͣ������ӵ�����ԭ��Oԭ�Ӳ���1��2sԭ�ӹ����3��2pԭ�ӹ���ӻ����ʴ�Ϊ�������Σ�3��2p��
����61��31��=1��Ϊ�����ͣ������ӵ�����ԭ��Oԭ�Ӳ���1��2sԭ�ӹ����3��2pԭ�ӹ���ӻ����ʴ�Ϊ�������Σ�3��2p��
��5����Cu���ʵķ�ĩ����NH3��Ũ��Һ�У�ͨ��O2����ַ�Ӧ����Һ������ɫ������[Cu��NH3��4]2+���÷�Ӧ�����ӷ���ʽ�ǣ�2Cu+8 NH3H2O+O2=2[Cu��NH3��4]2++4OH-+6H2O���ʴ�Ϊ��2Cu+8 NH3H2O+O2=2[Cu��NH3��4]2++4OH-+6H2O��
��6�����Ľ����ܶѻ���ʽΪ���������ṹ����������ԭ�ӵ���λ��Ϊ8������ԭ�Ӱ뾶Ϊrcm�����������к���1+8��![]() =2����ԭ�ӣ���������Խ�����Ϊ������ԭ�����У�����Խ���Ϊ4rcm�������߳�Ϊ��
=2����ԭ�ӣ���������Խ�����Ϊ������ԭ�����У�����Խ���Ϊ4rcm�������߳�Ϊ��![]() rcm���������Ϊ����
rcm���������Ϊ����![]() rcm��3�����Ը�������
rcm��3�����Ը�������![]() =
=![]() =
=![]() �����r=
�����r=![]() ��
��![]() cm���ʴ�Ϊ��8��
cm���ʴ�Ϊ��8��![]() ��
��![]() ��
��

 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�