题目内容
【题目】氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
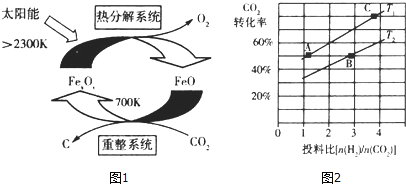
(1)科学家提出由CO2制取C的太阳能工艺如图1所示,若“重整系统”发生的反应中![]() =6,则FexOy的化学式为____________。
=6,则FexOy的化学式为____________。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1
CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJmol-1
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H3= ____________ kJmol-1
CH3OCH3(g)+3H2O(g)△H3= ____________ kJmol-1
(3)①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是____________(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的![]() 值变小
值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图2所示.
T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)= ____________ 。
③上述合成二甲醚的过程中提高CO2的转化率可采取的措施有____________、____________ (回答2点)。
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH4+)____c(HCO3-)(填“>”、“<’’或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=____________ (己知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol/L, H2CO3的电离平衡常数K1=4×10-7 mol/L,K2= 4×10-11 mol/L)
NH3·H2O+H2CO3的平衡常数K=____________ (己知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol/L, H2CO3的电离平衡常数K1=4×10-7 mol/L,K2= 4×10-11 mol/L)
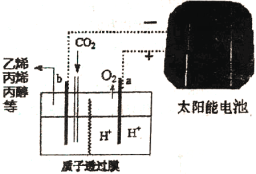
(5)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图3所示,电解时其中b极上生成乙烯的电极反应式为____________。
【答案】(1)Fe3O4;
(2)-130.8;
(3)①b;②0.18 mol/(Lmin);③增大氢气与二氧化碳的投料比、增大压强、降低温度等
(4)>;1.25×10-3;
(5)2CO2+12H++12e-=C2H4+4H2O
【解析】
试题分析:(1)由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中![]() =6,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4,故答案为:Fe3O4;(2)已知:Ⅰ.CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1
=6,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4,故答案为:Fe3O4;(2)已知:Ⅰ.CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1
Ⅱ.CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJmol-1
根据盖斯定律,Ⅰ×2-Ⅱ可得:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g),△H3=2△H1-△H2=2×(-53.7kJmol-1)-23.4kJmol-1=-130.8kJmol-1,故答案为:-130.8;
CH3OCH3(g)+3H2O(g),△H3=2△H1-△H2=2×(-53.7kJmol-1)-23.4kJmol-1=-130.8kJmol-1,故答案为:-130.8;
(3)①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故a错误;b.H2的转化率增大,平衡一定正向移动,故b正确;c.反应物的体积百分含量减小,可能是增大生成物浓度,平衡逆向移动,故c错误;d.容器中的![]() 值变小,可能是减小二氧化碳物质的量,平衡逆向移动,故d错误,故选b;
值变小,可能是减小二氧化碳物质的量,平衡逆向移动,故d错误,故选b;
②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6mol×60%×![]() =1.8mol,所以平均反应速率v(CH3OCH3)=
=1.8mol,所以平均反应速率v(CH3OCH3)=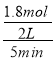 0.18 mol/(Lmin);故答案为:0.18 mol/(Lmin);
0.18 mol/(Lmin);故答案为:0.18 mol/(Lmin);
③根据2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g),△H3=-130.8kJmol-1,提高CO2的转化率可采取的措施有增大氢气与二氧化碳的投料比、增大压强、降低温度,故答案为:增大氢气与二氧化碳的投料比、增大压强、降低温度等;
CH3OCH3(g)+3H2O(g),△H3=-130.8kJmol-1,提高CO2的转化率可采取的措施有增大氢气与二氧化碳的投料比、增大压强、降低温度,故答案为:增大氢气与二氧化碳的投料比、增大压强、降低温度等;
(4) 根据NH3·H2O的电离平衡常数Kb=2×10-5mol/L, H2CO3的电离平衡常数K1=4×10-7 mol/L,K2= 4×10-11 mol/L知,HCO3-的水解程度大于NH4+,在NH4HCO3溶液中,在NH4HCO3溶液中,c(NH4+)大于c(HCO3-);反应NH4++HCO3-+H2O═NH3·H2O+H2CO3的平衡常数K=![]()
![]() =
=![]() =1.25×10-3,故答案为:>;1.25×10-3;
=1.25×10-3,故答案为:>;1.25×10-3;
(5)电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故答案为:2CO2+12H++12e-=C2H4+4H2O。