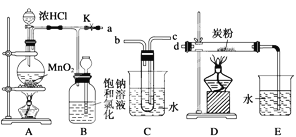
题目内容
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
N2O4(无色) △H<0,在100℃时,将0.40mol NO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
n(NO2) | 0.40 | a | 0.26 | c | d | e |
n(N2O4) | 0.00 | 0.05 | b | 0.08 | 0.08 | 0.08 |
(1)100s后降低反应混合物的温度,混合气体的颜色_________(填“变浅”、“变深”或“不变”)。
(2)20至40s内,v(NO2)=__________mol/(L·s),100℃时该反应的平衡常数K =_____________。
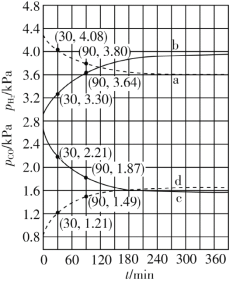
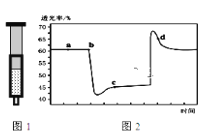
(3)将一定量的NO2充入密闭注射器中,图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是______________
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若密闭注射器为绝热容器,则T(b)>T(c)
D.d点时v(正)>v(逆)
(4)能说明反应2NO2(红棕色)![]() N2O4(无色)达平衡的是_________
N2O4(无色)达平衡的是_________
A. 体系的颜色不变 B. 恒容条件下,气体的密度不变
C. 2v正(NO2)=v逆(N2O4) D. 混合气体的平均摩尔质量不变
【答案】变浅 0.001 2.78 A AD
【解析】
(1)该反应△H<0,为放热反应,降温平衡右移;
(2)根据![]() 进行计算,根据K=
进行计算,根据K=![]() 进行计算;
进行计算;
(3)该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析;;
(4)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(1)二氧化氮为红棕色,该反应△H<0,为放热反应,降温平衡右移,二氧化氮浓度减小,混合气体颜色变浅,故答案为:变浅;
(2)20s时生成的n(N2O4)=0.05mol,根据方程式2NO2![]() N2O4可知消耗的二氧化氮为0.1mol,所以a=0.30mol,容器的体积为2L,所以20至40s内,v(NO2)=
N2O4可知消耗的二氧化氮为0.1mol,所以a=0.30mol,容器的体积为2L,所以20至40s内,v(NO2)= 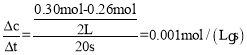 ;60s后N2O4的浓度不在发生变化,说明反应达到平衡,100℃时平衡时n(N2O4)=0.08mol,消耗二氧化氮为0.16mol,所以e=0.24mol,容器体积为2L,所以平衡时c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,K=
;60s后N2O4的浓度不在发生变化,说明反应达到平衡,100℃时平衡时n(N2O4)=0.08mol,消耗二氧化氮为0.16mol,所以e=0.24mol,容器体积为2L,所以平衡时c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,K=![]() =
=![]() ,故答案为:0.001;2.78;
,故答案为:0.001;2.78;
(3)A、b点之后,c点之前,透光率先减小,后小幅度上升,压缩注射器后,二氧化氮浓度增大,后由于压强增大平衡右移,二氧化氮浓度有所减小,故A正确;
B、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),故C错误;
D、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;
故答案为:A;
(4)A.平衡逆向移动颜色加深,正向移动颜色变浅,故颜色不变时说明反应达到平衡,故A正确;
B.恒容条件下气体总体积不变,总质量不变,故密度一直不变,故B错误;
C.反应达到平衡时v正(NO2)=v逆(NO2) ,v逆(NO2)= 2v逆(N2O4),所以2v正(NO2)=v逆(N2O4)不能说明反应达到平衡,故C错误;
D.混合气体的总质量不变,正向移动气体物质的量减少,平均摩尔质量增大,所以平均摩尔质量不变时能说明反应达到平衡,故D正确;
故答案为AD。

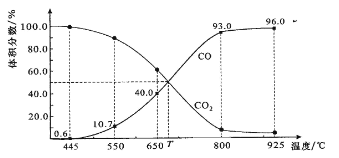
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)某温度,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(4)若在(3)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为__________,CO2的物质的量为__________。
a.等于1.0mol b.大于1.0mol c.大于0.5mol,小于1.0mol d.无法确定
(5)根据研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ·mol-1
4NH3(g)+3O2(g) ΔH=akJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的
②已知:N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:_____________________________。