题目内容
【题目】熔盐级硝酸钠大量应用于太阳能储热介质,一种以工业纯碱(纯度为98%,杂质为NaCl)和生产硝酸产生的NO,废气(含NO、NO2)为原料分离亚硝酸钠并制取熔盐级硝酸钠的工艺流程如图所示。回答下列问题:
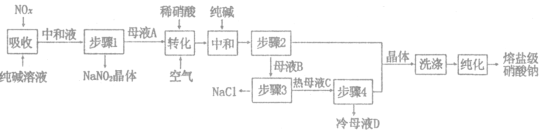
(1)纯碱“吸收”NO、NO2反应的化学方程式为_______________.“中和液”所含溶质除NaCl及少量Na2CO3外,还有___________(填化学式)。
(2)母液A加人稀硝酸生成有NO.写出“转化”时加入稀硝酸反应的离子方程式___________
(3)“洗涤”时可以使用母液___________(填“A”或“B”),晶体"纯化”的方法为___________(填操作名称)。
(4)“步骤3”需要高温分离NaCl固体.原因是_______________,母液D可返回步骤___________(填“2”或“3”)循环使用。
(5)若得到NaNO2、NaNO3两种产品的物质的量之比为2:1,假定Na2CO3恰好完全反应,则生产1.38吨NaNO2时,工业纯碱的理论用量为___________吨(保留3位有效数字)。
【答案】Na2CO3+NO+NO2=2NaNO2+CO2 NaNO2、NaNO3 3NO2-+2H+=NO3-+2NO+H2O B 重结晶 防止NaNO3的析出 3 1.62
【解析】
根据工艺流程图,用纯碱吸收氮氧化合物,反应生成CO2和NaNO2,中和后得到中和液经步骤1得到NaNO2晶体和含有NaNO2的母液A,加入稀硝酸并通入空气进行转换得生成NO和NaNO3,再加入适量的纯碱中和稀硝酸,经步骤2得到含有NaNO3的母液B和NaNO3晶体,母液B经高温分离出NaCl和热母液C,再经步骤4得到含NaNO3的冷母液D和NaNO3晶体,最终经洗涤转化得到熔盐级硝酸钠,据此分析解答。
(1)根据上述分析,用纯碱吸收氮氧化合物,发生反应生成CO2和NaNO2,反应方程式为Na2CO3+NO+NO2=2NaNO2+CO2,“中和液”所含溶质除NaCl及少量Na2CO3外,还含有生成的NaNO2及部分NaNO3,故答案为:Na2CO3+NO+NO2=2NaNO2+CO2;NaNO2、NaNO3;
(2)“转化”过程中,含有NaNO2的母液A加入稀硝酸生成NO和NaNO3,反应的离子方程式为3NO2-+2H+=NO3-+2NO+H2O,故答案为:3NO2-+2H+=NO3-+2NO+H2O;
(3)母液B含有大量的NaNO3,因此在洗涤硝酸钠可适用母液B来进行洗涤,纯化NaNO3晶体时,可采用重结晶的方法,提高晶体的纯度,故答案为:B;重结晶;
(4)NaNO3的溶解度随温度的升高而升高,而NaCl的溶解度随温度变化较小,因此为了防止NaNO3的析出,需要在高温的条件下分离NaCl固体,母液D液含NaNO3,可返回步骤3循环使用,故答案为:防止NaNO3的析出;3;
(4)生产1.38吨NaNO2时,![]() ,已知NaNO2、NaNO3两种产品的物质的量之比为2:1,则n(NaNO3)=1×104mol,由Na原子守恒可以知道,n(Na2CO3)=
,已知NaNO2、NaNO3两种产品的物质的量之比为2:1,则n(NaNO3)=1×104mol,由Na原子守恒可以知道,n(Na2CO3)=![]() [n(NaNO2)+n(NaNO3)]=1.5×104mol,则m(Na2CO3)=1.5×104mol×106g/mol=1.59×106g,则需要工业纯碱的用量为1.59×106g÷98%≈1.62×106g=1.62t,故答案为:1.62。
[n(NaNO2)+n(NaNO3)]=1.5×104mol,则m(Na2CO3)=1.5×104mol×106g/mol=1.59×106g,则需要工业纯碱的用量为1.59×106g÷98%≈1.62×106g=1.62t,故答案为:1.62。

 阅读快车系列答案
阅读快车系列答案【题目】学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
(1)实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、___、___、___等;
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾;
(2)实验步骤:略;
(3)实验数据:
实验编号 | KClO3质量(g) | 氧化物化学式 | 氧化物质量(g) | 氧化物回收率 | 产生气体(mL)(已折算到标况) | 耗时(s) |
1 | 0.60 | 10 | 480 | |||
2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(4)实验讨论:
a.在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、____;
b.实验编号3的实验中KClO3的分解率为____%(保留一位小数);
c.在用Cr2O3做研究实验时,发现有黄绿色刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,该刺激性气体是___(填分子式),可用____试纸检验,上述异常现象产生的原因是____;
(5)实验结论:____。