题目内容
【题目】一种新型的电解废水处理技术是以活性炭为电极板和粒子凝胶颗粒填充的电解装置(如图所示)。用该装置电解过程中产生的羟基自由基(OH)氧化能力极强,能氧化苯酚为CO2、H2O。下列说法错误的是
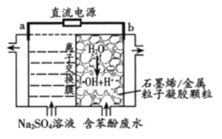
A.阳极电极反应为2H2O—4e-=O2↑+H+
B.H+通过离子交换膜向阴极移动
C.苯酚被氧化的化学方程式为C6H5OH+28OH=6CO2↑+17H2O
D.每转移0.7mole一两极室共产生气体体积为11.2L(标况)
【答案】A
【解析】
根据图示,b电极中,H2O变为羟基自由基(OH)和H+,发生氧化反应,则b为阳极,a为阴极,据此分析解答。
A.根据分析,b为阳极,结合图示,电极反应中产生羟基自由基(OH)和H+,没有生成氧气,正确的电极反应为:H2O—e-=OH +H+,故A错误;
B.该装置为电解池,阳离子向阴极移动,阳极产生H+向a电极移动,a为阴极,故B正确;
C.根据题干信息,羟基自由基(OH)氧化能力极强,能氧化苯酚为CO2、H2O,苯酚被氧化的化学方程式为C6H5OH+28OH=6CO2↑+17H2O,故C正确;
D.根据分析和电解池中阴阳离子在电极上的放电顺序,a电极上氢离子放电,电极反应为:2H++2e-=H2↑,b电极的电极反应为:H2O—e-=OH+H+,结合苯酚的氧化过程C6H5OH+28OH=6CO2↑+17H2O,当转移0.7mole一,b电极生成0.7molOH,氧化苯酚时,生成![]() mol=0.15mol CO2,标况下的体积为0.15mol×22.4L/mol=3.36L,当转移0.7mole一,a电极上生成0.35mol的氢气,标况下的体积为0.35mol×22.4L/mol=7.84L,两极室共产生气体体积为3.36L+7.84L=11.2L(标况),故D正确;
mol=0.15mol CO2,标况下的体积为0.15mol×22.4L/mol=3.36L,当转移0.7mole一,a电极上生成0.35mol的氢气,标况下的体积为0.35mol×22.4L/mol=7.84L,两极室共产生气体体积为3.36L+7.84L=11.2L(标况),故D正确;
答案选A。

 名校课堂系列答案
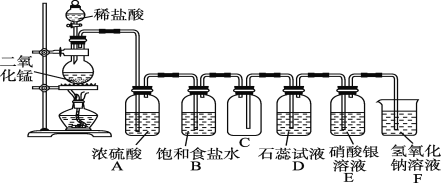
名校课堂系列答案【题目】实验室探究制备高锰酸钾的绿色化方案,其实验流程如下:
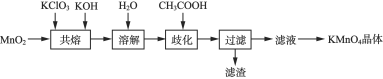
已知:![]() 水溶液呈墨绿色,在酸性、中性和弱碱性环境下,
水溶液呈墨绿色,在酸性、中性和弱碱性环境下,![]() 会发生自身氧化还原(歧化)反应,生成
会发生自身氧化还原(歧化)反应,生成![]() 和
和![]() ;部分试剂熔点、分解温度见下表:
;部分试剂熔点、分解温度见下表:
物质 |
|
|
|
|
|
熔点/ | 406 | 368 | —— | —— | —— |
分解温度/ | 1323 |
| 530 | 190 | 240 |
(1)在强碱性条件下,![]() 与
与![]() 共熔可制得
共熔可制得![]() ,其化学方程式为________。投料的顺序为先加入
,其化学方程式为________。投料的顺序为先加入![]() 和
和![]() 混合均匀,待小火完全熔融,再加入
混合均匀,待小火完全熔融,再加入![]() ,迅速搅拌。不能先将
,迅速搅拌。不能先将![]() 与
与![]() 混合的原因是________。
混合的原因是________。
(2)溶解后所得溶液转入三颈瓶中,趁热滴入![]() 的乙酸,调节
的乙酸,调节![]() ,在如下图所示的装置中进行歧化。
,在如下图所示的装置中进行歧化。
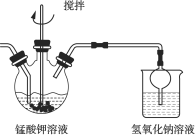
①该步骤中如果pH控制过高,可能会导致________。
②判断三颈瓶中![]() 完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到________,表示
完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到________,表示![]() 已完全反应。
已完全反应。
(3)从提高原料利用率的角度分析,本实验流程的优点是________________。
(4)设计以滤液为原料,制取![]() 晶体的实验方案:________________(已知
晶体的实验方案:________________(已知![]() 在水溶液中,
在水溶液中,![]() 以上开始分解。实验中必须使用的设备:蒸发皿、恒温水浴槽、恒温干燥箱)。
以上开始分解。实验中必须使用的设备:蒸发皿、恒温水浴槽、恒温干燥箱)。