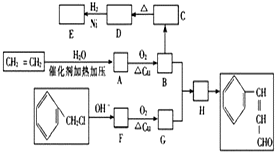
题目内容
9.将4mol SO2与2mol O2放入2L的密闭容器中,5min后反应达到平衡:2SO2(g)+O2(g)?2SO2(g)测得平衡时混合物总的物质的量为5mol,求.(1)用SO2表示该反应的反应速率;
(2)平衡时各物质的浓度;
(3)平衡时SO2的转化率.
分析 将4mol SO2与2mol O2放入2L的密闭容器中,5min后反应达到平衡,测得平衡时混合物总的物质的量为5mol,设参加反应的二氧化硫为xmol,则:
2SO2(g)+O2(g)?2SO2(g)
起始量(mol):4 2 0
变化量(mol):x 0.5x x
平衡量(mol):4-x 2-0.5x x
则4-x+2-0.5x+x=5,解得x=2
(1)根据v=$\frac{△c}{△t}$计算v(SO2);
(2)根据v=$\frac{n}{V}$计算各物质的浓度;
(3)转化率=$\frac{参加反应S{O}_{2}物质的量}{S{O}_{2}起始物质的量}$×100%.
解答 解:将4mol SO2与2mol O2放入2L的密闭容器中,5min后反应达到平衡,测得平衡时混合物总的物质的量为5mol,设参加反应的二氧化硫为xmol,则:
2SO2(g)+O2(g)?2SO2(g)
起始量(mol):4 2 0
变化量(mol):x 0.5x x
平衡量(mol):4-x 2-0.5x x
则4-x+2-0.5x+x=5,解得x=2,
(1)v(SO2)=$\frac{\frac{2mol}{2L}}{5min}$=0.2mol/(L.min),
答:用SO2表示该反应的反应速率为0.2mol/(L.min);
(2)平衡时二氧化硫浓度为$\frac{(4-2)mol}{2L}$=1mol/L,氧气浓度为$\frac{(2-2×0.5)mol}{2L}$=0.5mol/L,三氧化硫的浓度为$\frac{2mol}{2L}$=1mol/L,
答:平衡时二氧化硫浓度为1mol/L,氧气浓度为0.5mol/L,三氧化硫的浓度为1mol/L;
(3)二氧化硫转化率=$\frac{2mol}{4mol}$×100%=50%,
答:二氧化硫的转化率为50%.
点评 本题考查化学平衡的计算,比较基础,旨在考查学生对基础知识的掌握,注意三段式在化学平衡计算中应用.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 若pH=7,c(HA)=0.1 mol/L | |
| B. | 若pH<7,微粒浓度关系可能为:c(Na+)=c(HA)+c(A-) | |
| C. | 若pH>7,c(A-)>c(Na+) | |
| D. | 若pH=12,且HA为强酸时,c(HA)=0.08 mol/L |
| A. | 失去电子的反应为还原反应 | B. | 含有氧元素的物质是氧化剂 | ||
| C. | 还原剂是化合价升高的物质 | D. | 氧化剂和还原剂不可能是同一物质 |
| A. | 0.1mol/L | B. | 0.4mol/L | C. | 0.3mol/L | D. | 0.15mol/L |
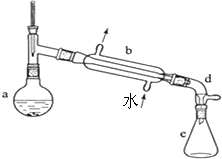 某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
相关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
Ⅰ.[合成]:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入10mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
Ⅱ.[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得12.30g纯环己烯.
回答下列问题:
(1)装置b的名称是直形冷凝管.加入沸石的目的是防止混合液爆沸.
(2)本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(3)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4,加入无水CaCl2的作用是干燥所得环己烯(产物).
(4)本实验所得环己烯的产率是75%(产率=$\frac{实际产量}{理论产量}$×100%)
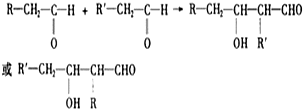

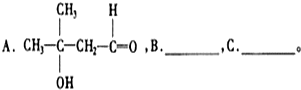
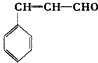 )和丁醇.请在下列合成线路的方框中填上有关物质的结构简式.
)和丁醇.请在下列合成线路的方框中填上有关物质的结构简式.