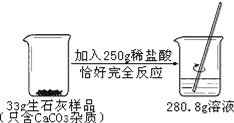
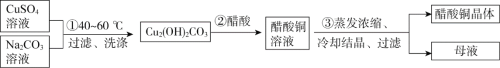
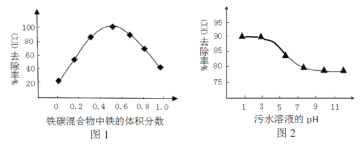
题目内容
【题目】(1)钠与氧气的反应会因条件不同而导致现象不同,产物不同,反应的实质也不同。据此回答下列问题:
①常温下,在空气中切开金属钠,钠的断面由银白色逐渐变暗而失去金属光泽,请用化学方程式解释这种现象产生的原因:__________________。
②钠在空气中受热所发生反应的化学方程式是__________________。
③将4.6克钠投入足量水中,标况下生成气体的体积是__________。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为____________。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为___________________________________。
③实验室制备Al(OH)3的常用方法是向Al2(SO4)3溶液中逐滴滴加氨水至过量,请写出对应的化学方程式:___________________________________。
(3)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
①中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是_______。
②写出磁石的主要成分和盐酸反应的离子方程式______________。
【答案】4Na+O2=2Na2O 2Na+O2![]() Na2O2 2.24L HCO3-+H+=CO2↑+H2O Al(OH)3+3H+=Al3++3H2O Al2(SO4)3+6NH3·H2O=2Al(OH)3↓ + 3(NH4)2SO4 Fe3O4 Fe3O4 +8HCl=2FeCl3+ FeCl2+4H2O
Na2O2 2.24L HCO3-+H+=CO2↑+H2O Al(OH)3+3H+=Al3++3H2O Al2(SO4)3+6NH3·H2O=2Al(OH)3↓ + 3(NH4)2SO4 Fe3O4 Fe3O4 +8HCl=2FeCl3+ FeCl2+4H2O
【解析】
(1)①常温下,在空气中切开金属钠发生反应:4Na+O2=2Na2O,钠的断面由银白色逐渐变暗而失去金属光泽,故答案为:4Na+O2=2Na2O;
②钠在空气中受热反应生成过氧化钠,反应的化学方程式为2Na+O2![]() Na2O2,故答案为:2Na+O2
Na2O2,故答案为:2Na+O2![]() Na2O2;
Na2O2;
③4.6g Na的物质的量为![]() =0.2mol,根据2Na + 2H2O=2NaOH + H2↑,生成氢气物质的量为
=0.2mol,根据2Na + 2H2O=2NaOH + H2↑,生成氢气物质的量为![]() =0.1mol,标况下氢气的体积为0.1mol×22.4L/mol=2.24L,故答案为:2.24L;
=0.1mol,标况下氢气的体积为0.1mol×22.4L/mol=2.24L,故答案为:2.24L;
(2)①用小苏打片(NaHCO3)治疗胃酸过多,是碳酸氢钠与盐酸反应,反应的离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O;
②Al(OH)3与盐酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
③Al2(SO4)3溶液中逐滴滴加氨水至过量反应生成氢氧化铝沉淀,反应的化学方程式为Al2(SO4)3+6NH3·H2O =2Al(OH)3↓+3(NH4)2SO4,故答案为:Al2(SO4)3+6NH3·H2O =2Al(OH)3↓+3(NH4)2SO4;
(3)①制作指南针的天然磁石的主要成分为Fe3O4,故答案为:Fe3O4;
②四氧化三铁和盐酸反应的离子方程式为Fe3O4 +8HCl= 2FeCl3+FeCl2+4H2O,故答案为:Fe3O4 +8HCl= 2FeCl3+FeCl2+4H2O。