题目内容
【题目】下列说法正确的是
A. 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0,△S>0
B. 常温下,NH4Cl溶液加水稀释 增大
增大
C. 电解饱和食盐水产生了11.2LH2,则反应中转移的电子数为6.02×1023
D. 在NaCl和KI均为0.1 mo1·L-1的混合溶液中滴加AgNO3溶液,则先产生黄色沉淀
【答案】AD
【解析】A.MgCl2(1)═Mg(1)+Cl2(g)该反应为吸热、熵值增大的反应,即MgCl2(1)═Mg(1)+Cl2(g)的△H>0,△S>0,故A正确;B.用水稀释NH4Cl 时,发生水解反应NH4++H2OH++NH3H2O,则水解平衡常数K=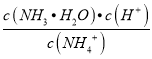 ,温度不变,则
,温度不变,则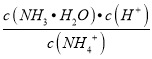 不变,故B错误;C.未注明是否为标准状况,无法计算11.2LH2的物质的量,故C错误;D.碘化银的溶解度小于氯化银,因此在NaCl和KI均为0.1 mo1·L-1的混合溶液中滴加AgNO3溶液,则先产生溶解度小的碘化银黄色沉淀,故D正确;故选AD。
不变,故B错误;C.未注明是否为标准状况,无法计算11.2LH2的物质的量,故C错误;D.碘化银的溶解度小于氯化银,因此在NaCl和KI均为0.1 mo1·L-1的混合溶液中滴加AgNO3溶液,则先产生溶解度小的碘化银黄色沉淀,故D正确;故选AD。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】一定温度下,在三个体积均为0.5L的密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中5 min时到达平衡。下列说法中正确的是
COCl2(g),其中容器Ⅰ中5 min时到达平衡。下列说法中正确的是
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.32 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO 0.8 mol、Cl20.8 mol,达到平衡时CO转化率大于80%
【题目】下表是A、B、C三种有机物的有关信息:
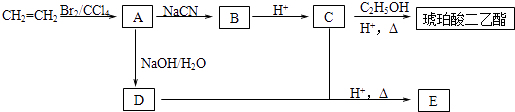
A | ①能使溴的四氧化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成C |
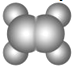
B | ①由C、H、O三种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与B反应生成相对分子质量为88的酯 |
请结合信息回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式____________________________,反应类型为______________。
(2)A与氢气发生加成反应后生成物质D,写出符合下列要求的有机物的结构简式:_______。
①与D互为同系物 ②分子中碳原子总数是4 ③分子里带有一个支链
(3)对于物质B有关说法正确的是_____ (填序号) 。
①无色无味液体 ②有毒 ③易溶于水 ④具有酸性,能与碳酸钙反应 ⑤官能团是-OH
(4)写出在浓硫酸作用下,B与C反应生成酯的化学方程式________________________________。
(5)下列试剂中,能用于检验C中是否含有水的是______ (填序号)。
①CuSO4·5H2O ②无水硫酸铜 ③浓硫酸 ④金属钠