题目内容
【题目】将一定质量的铜片加入到20 mL某浓度的浓硝酸中,充分反应后,铜片全部溶解,并收集到标准状况下的混合气体共896mL(假设[体中只有NO和NO2)。向反应后所得溶液中逐滴滴加lmol/L的NaOH溶液,产生沉淀质量与加入NaOH溶液体积(单位: mL)的关系如图所示。回答下列问题:
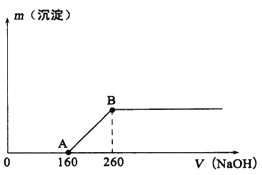
(1)B点所表示溶液中只含一种溶质,该物质是______(填化学式)。
(2)收集的气体中,NO2的物质的量为_______mol。
(3)原浓硝酸的浓度为_______mol/L。
(4)欲使铜与硝酸产生的混合气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要30%的双氧水______g(保留两位有效数字)。
【答案】 NaNO3 0.01 15 5.7
【解析】分析:铜与硝酸反应生成硝酸铜、NO、NO2和H2O,向反应后所得溶液中逐滴滴加lmol/L的NaOH溶液,根据图像可知开始阶段没有沉淀产生,说明硝酸过量,0~160mL氢氧化钠用来中和过量的硝酸;160~260mL氢氧化钠用来沉淀铜离子,据此解答。
详解:(1)B点时沉淀质量不再发生变化,因此溶液中的溶质是硝酸钠,化学式为NaNO3;
(2)沉淀铜离子消耗氢氧化钠是260mL-160mL=100mL,物质的量是0.1mol,根据电荷守恒可知铜失去电子的物质的量就是消耗的氢氧根离子的物质的量,为0.1mol。设收集的气体中NO和NO2的物质的量分别是xmol、ymol,则根据电子得失守恒和原子守恒可知x+y=0.896÷22.4=0.04,3x+y=0.1,解得x=0.03、y=0.01,即NO2的物质的量为0.01mol。
(3)铜的物质的量是0.1mol÷2=0.05mol,生成硝酸铜是0.05mol。剩余硝酸的物质的量是0.16L×1mol/L=0.16mol,则根据氮原子守恒可知原浓硝酸的物质的量是0.16mol+0.05mol×2+0.04mol=0.3mol,则浓度为0.3mol÷0.02L=15mol/L。
(4)欲使铜与硝酸产生的混合气体在氢氧化钠溶液中全部转化为硝酸钠,根据电子得失守恒可知双氧水得到的电子的物质的量就是金属铜失去电子的物质的量,为0.1mol,1mol双氧水得到2mol电子,则需要双氧水是0.05mol,因此至少需要30%的双氧水的质量是![]() 。
。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】下表是A、B、C三种有机物的有关信息:
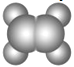
A | ①能使溴的四氧化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成C |
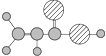
B | ①由C、H、O三种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与B反应生成相对分子质量为88的酯 |
请结合信息回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式____________________________,反应类型为______________。
(2)A与氢气发生加成反应后生成物质D,写出符合下列要求的有机物的结构简式:_______。
①与D互为同系物 ②分子中碳原子总数是4 ③分子里带有一个支链
(3)对于物质B有关说法正确的是_____ (填序号) 。
①无色无味液体 ②有毒 ③易溶于水 ④具有酸性,能与碳酸钙反应 ⑤官能团是-OH
(4)写出在浓硫酸作用下,B与C反应生成酯的化学方程式________________________________。
(5)下列试剂中,能用于检验C中是否含有水的是______ (填序号)。
①CuSO4·5H2O ②无水硫酸铜 ③浓硫酸 ④金属钠
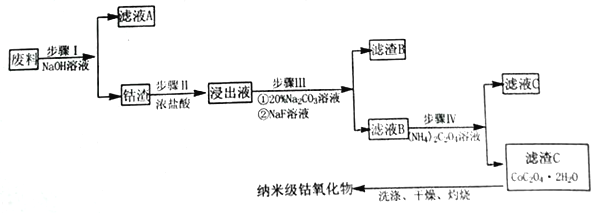
【题目】纳米氧化钴在半导体和微电子行业应用广泛,某些金属废料中含有Co元素,从废料(含Co3O4、Al2O3、Li2O、Fe2O3等物质) 中制备高纯度的纳米级钴的氧化物,流程如下
已知:
①LiF 难溶于水,Li2CO3微溶于水;
②钴元素常见的化合价为+2 和+3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中发生的离子反应方程式_______________;
(2)步骤II加浓盐酸的作用是_______________;
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为_______________; 滤渣 B 的主要成分为_________________;
(4)简述如何检验滤液B中是否还有残留的Fe3+:_______________;
(5) 经过反复洗涤、干燥后称重,将质量为3.66gCoC2O4·2H2O进行灼烧,残留固体质量如图所示。

210℃~290℃时若生成两种气体,则发生反应的化学方程式为_______________,400℃~500℃所得固体的化学式为_______________;