题目内容
15.下列说法不正确的是( )| A. | 0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+)=c(OH -)+2c(CO32-)+c(HCO3-) | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡 | |
| D. | 常温常压下能自发进行的反应,一定都是放热反应 |
分析 A.硫酸铵分子中含有2个铵根离子,且铵根离子水解程度较小、硫酸根离子不水解,则c (NH4+)>c(SO42-)>c(H+);
B.溶液中一定存在电荷守恒,根据电荷守恒分析;
C.钡离子与碳酸根离子反应,导致碳酸根离子水解平衡逆向移动;
D.自发进行的反应判断依据是△H-T△S<0,常温常压下可能是吸热反应.
解答 解:A.0.1mol/L硫酸铵溶液中,铵根离子部分水解,则溶液显示酸性:c(H+)>c(OH-),硫酸铵分子中含有2个铵根离子,且铵根离子水解程度较小、硫酸根离子不水解,则c (NH4+)>c(SO42-)>c(H+),则溶液中各离子的浓度由大到小的顺序为:c (NH4+)>c(SO42-)>c(H+)>c(OH-),故A正确;
B.在苏打与小苏打的混合溶液中一定存在电荷守恒:c(Na+)+c(H+)=c(OH -)+2c(CO32-)+c(HCO3-),故B正确;
C.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,红色褪去,钡离子与碳酸根离子反应,导致碳酸根离子水解平衡逆向移动,验证Na2CO3溶液中存在水解平衡,故C正确;
D.自发进行的反应判断依据是△H-T△S<0,可能是吸热反应,△H>0,△S>0,常温下可能满足△H-T△S<0,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,试题涉及盐的水解原理及其应用、反应热与自发进行的判断、离子浓度大小比较等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
6.高分子材料可以用作电绝缘材料,这是因为( )
| A. | 高分子的结构是长链状的 | |
| B. | 高分子间相互作用的分子间力较强 | |
| C. | 高分子化合物链里的原子是以共价键结合的 | |
| D. | 高分子链之间发生了缠绕 |
3.已知可逆反应:X(g)+3Y(g)═2Z(g)△H<0,甲、乙为恒容、等体积的真空密闭容器,向甲中加入1molX和 3molY,在一定条件下达到平衡时放出热量为Q1KJ.在相同条件下,向乙容器中加入2molZ,达到平衡时吸收热量Q2KJ,已知 Q1=3Q2.下列叙述正确的是( )
| A. | 平衡时甲、乙中Z的体积分数甲>乙 | |
| B. | 平衡时甲中X的转化率为75% | |
| C. | 达到平衡后,再向乙中加入0.25molX,0.75molY和1.5molZ,平衡向生成x的方向移动 | |
| D. | 乙中反应的热化学方程式:2Z(g)═X(g)+3Y(g)△H=+Q2kJ•mol-1 |
10.下列电离方程式书写正确的是( )
| A. | Al2(SO4)3═Al23++3SO42- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3═Na++H++CO32- | D. | Na3PO4═3Na++PO43- |
20.下列分子中,所有原子都满足最外层为8电子结构的是( )
| A. | H2O | B. | BF3 | C. | COCl2 | D. | SF6 |
7.发现116号元素R,其最外层有6个电子,下列叙述正确的是:①其钠盐化学式为Na2R,②其最高价氧化物的水化物是强酸,③R是金属元素,④R是非金属元素,⑤其最高价氧化物化学式为RO3.( )
| A. | ①③⑤ | B. | ②④ | C. | ③⑤ | D. | ②③⑤ |
4.下列分子中,中心原子以sp3杂化且属于极性分子的是( )
| A. | CCl4 | B. | BF3 | C. | CO | D. | NH3 |
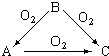 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.