题目内容
4.下列分子中,中心原子以sp3杂化且属于极性分子的是( )| A. | CCl4 | B. | BF3 | C. | CO | D. | NH3 |
分析 分子空间结构不对称,正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子;中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断.
解答 解:A、CCl4分子中价层电子对个数=4+$\frac{1}{2}$×(4-4×1)=4且不含孤电子对,为正四面体结构,为非极性分子,中心原子sp3采用杂化,故A错误;
B、BF3分子中价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=3且不含孤电子对,为平面三角形结构,为非极性分子,中心原子sp2采用杂化,故B错误;
C、CO中C原子形成1个δ键,有1对孤电子对,为sp杂化,故C错误;
D、NH3中N原子形成3个δ键,有1个孤电子对,为sp3杂化,分子构型为三角锥形,空间结构不对称为极性分子,故D正确;
故选D.
点评 本题考查极性分子和非极性分子判断、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,知道孤电子对个数的计算方法,为易错点.

练习册系列答案
相关题目
14.已知自然界氧的同位素有16O、17O、18O,水中氢的同位素有H、D,从水分子的原子组成来看,自然界的水分子可以有( )
| A. | 3种 | B. | 6种 | C. | 9 种 | D. | 12种 |
15.下列说法不正确的是( )
| A. | 0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+)=c(OH -)+2c(CO32-)+c(HCO3-) | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡 | |
| D. | 常温常压下能自发进行的反应,一定都是放热反应 |
19.氢、碳、氮、氧三种元素可组成许多重要的化合物.
(1)一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)△H<0达到平衡.其他条件不变时,下列措施能提高NO2转化率的是BC(填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ/mol-1
为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
此合成反应的a>0;△s>0,(填“>”、“<”或“=”)
(3)利用液氨合成尿素的反应在进行时分为如下两步.第一步:2NH3+CO2?H2NCOONH4,第二步:H2NCOONH4?H2O+H2NCONH2.在一体积为0.5L密闭容器中投入4.0mol液氨和1.0mol二氧化碳,实验测得反应中各组分随时间的变化如图1所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第2步反应决定,总反应进行到约55 min时到达平衡.
②反应进行到l0min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=0.148 mol/(L•min).
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图2:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.

(5)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
2NO2(g)?N2O4(g)△H=-56.9kJ•mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-810.1kJ/mol.
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.右图是通过光电转化原理以廉价原料制备新产品的示意图.写出上述光电转化过程的化学反应方程式2CO2+2H2O$\frac{\underline{\;光照\;}}{\;}$2HCOOH+O2.催化剂a、b之间连接导线上电子流动方向是a→b(填a→b或b→a).
(1)一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)△H<0达到平衡.其他条件不变时,下列措施能提高NO2转化率的是BC(填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ/mol-1
为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(3)利用液氨合成尿素的反应在进行时分为如下两步.第一步:2NH3+CO2?H2NCOONH4,第二步:H2NCOONH4?H2O+H2NCONH2.在一体积为0.5L密闭容器中投入4.0mol液氨和1.0mol二氧化碳,实验测得反应中各组分随时间的变化如图1所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第2步反应决定,总反应进行到约55 min时到达平衡.
②反应进行到l0min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=0.148 mol/(L•min).
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图2:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.

(5)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
2NO2(g)?N2O4(g)△H=-56.9kJ•mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-810.1kJ/mol.
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.右图是通过光电转化原理以廉价原料制备新产品的示意图.写出上述光电转化过程的化学反应方程式2CO2+2H2O$\frac{\underline{\;光照\;}}{\;}$2HCOOH+O2.催化剂a、b之间连接导线上电子流动方向是a→b(填a→b或b→a).
13.对二氧化氮的下列说法不正确的是( )
| A. | 二氧化氮不是硝酸的酸酐 | |
| B. | 二氧化氮与水的反应是氧化还原反应 | |
| C. | 二氧化氮不是造成大气污染的气体之一 | |
| D. | 在通常状况下测得的NO2的相对分子质量是不准确的 |
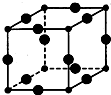 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用. .
.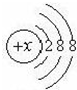 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空: .
.