题目内容
10.下列电离方程式书写正确的是( )| A. | Al2(SO4)3═Al23++3SO42- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3═Na++H++CO32- | D. | Na3PO4═3Na++PO43- |
分析 A.铝离子角标应转化为化学计量数;
B.NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子;
C.碳酸氢钠为弱酸的酸式盐,为强电解质,溶液中电离出钠离子和碳酸氢根离子;
D.磷酸钠属于盐,属于强电解质,完全电离出钠离子和磷酸根离子.
解答 解:A.硫酸铝强电解质,电离时电离出自由移动的铝离子和硫酸根离子,电离方程式为Al2(SO4)3=2Al3++3SO42-,故A错误;
B.NaHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离出Na+、H+、SO42-离子,电离方程式为:NaHSO4═Na++H++SO42-,故B错误;
C.碳酸氢钠属于强电解质,为弱酸的酸式盐,溶液中完全电离,碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3-,
D.Na3PO4能完全电离出钠离子和磷酸根离子,电离方程式为:Na3PO4=3Na++PO43-,故D正确;
故选D.
点评 本题考查了电离方程式的书写,注意明确电解质的强弱、电离方程式的书写方法、原子团及离子符号等即可解答,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案
相关题目
20.进行下列实验肯定不能获得成功的是( )
| A. | 用pH试纸鉴别浓硫酸与浓硝酸 | |
| B. | 用淀粉碘化钾溶液区分二氧化氮和二氧化碳 | |
| C. | 用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫 | |
| D. | 常温下用铜片和浓HNO3反应制取二氧化氮气体 |
1.分子式为C3H6Cl2的有机物,若再有一个氢原子被氯原子取代,生成的C3H5Cl3有两种同分异构体,原有的C3H6Cl2应该是( )
| A. | 1,3-二氯丙烷 | B. | 1,1-二氯丙烷 | C. | 1,2-二氯丙烷 | D. | 2,2-二氯丙烷 |
18.能源是人类生存与发展必不可缺的物质,对传统能源进行脱硫、脱硝处理,提高新能源在能源消费中的比倒是改变目前我国频发的雾霾天气的有效措施.
(1)肼(N2H4)和化合物甲是一种重要的火箭推进剂,甲分子与肼分子具有相同的电子数,二者反应的生成物中有l0e-分子,另一种生成物为极稳定的单质,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O;
(2)对燃煤产生的尾气进行回收处理,有助于空气质量的改善,还能变废为宝,尾气处理过程中涉及到的主要反应如下:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1
③2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mol-1l
④2H2 (g)+O2 (g)=2H2O(g)△H=-483.6kJ•mol-1
S(g)与O2(g)反应生成SO2 (g)的热化学方程式为S(g)+O2(g)=SO2 (g)△H=-574kJ•mol-1.
(3)煤碳液化也有助于减少雾霾天气的发生,液化反应之一为:
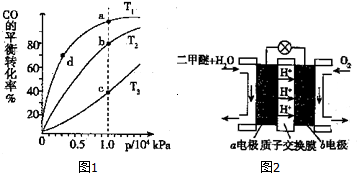
CO(g)+2H2(g)?CH3OH(g)△H<O;按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图1所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为v(d)<v(a)<v(b)<v(c);
实际生产条件控制在T1℃、1×l04kPa左右,选择此压强的理由是压强为1×l04kPa左右,CO的转化率已经很大,压强再增大,CO转化率提高不大,生成成本增大,得不偿失.
(4)工业上生产新能源二甲醚(CH3OCH3)的原理之一为:
2CO2(g)+6H2( g)?CH3OCH3(g)+3H2O(g).相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol•L1-)及正逆反应速率之间的关系如下表所示:
填写表中空白处并写出其推测过程I处于平衡状态,则平衡常数k=$\frac{1×1{0}^{-4}×(1×1{0}^{-4})^{3}}{(1×1{0}^{-2})^{2}×(1×1{0}^{-2})^{6}}$=1,Ⅱ中浓度商Qc=$\frac{1×1{0}^{-4}×(2×1{0}^{-4})^{3}}{(2×1{0}^{-2})^{2}×(1×1{0}^{-2})^{6}}$=2,则Qc>K=1,故反应向逆反应方向进行.
(5)二甲醚(燃烧热为1455kJ/mol)燃料电池是一种绿色电池,其工作原理如图2所示,a、b均为惰性电极,a极的电极反应式为CH3OCH3-12e-+3H2O═2CO2↑+12H+;当消耗1molO2时,通过质子交换膜的质子数为4NA;
若电池工作时消耗1mol二甲醚所能产生的最大电能为1320kJ,则该燃料电池的工作效率为90.7% (燃料电池的工作效率是指电池所产生的最大电能与燃料燃烧时所能释放的全部热能之比).

(1)肼(N2H4)和化合物甲是一种重要的火箭推进剂,甲分子与肼分子具有相同的电子数,二者反应的生成物中有l0e-分子,另一种生成物为极稳定的单质,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O;
(2)对燃煤产生的尾气进行回收处理,有助于空气质量的改善,还能变废为宝,尾气处理过程中涉及到的主要反应如下:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1
③2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mol-1l
④2H2 (g)+O2 (g)=2H2O(g)△H=-483.6kJ•mol-1
S(g)与O2(g)反应生成SO2 (g)的热化学方程式为S(g)+O2(g)=SO2 (g)△H=-574kJ•mol-1.
(3)煤碳液化也有助于减少雾霾天气的发生,液化反应之一为:
CO(g)+2H2(g)?CH3OH(g)△H<O;按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图1所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为v(d)<v(a)<v(b)<v(c);
实际生产条件控制在T1℃、1×l04kPa左右,选择此压强的理由是压强为1×l04kPa左右,CO的转化率已经很大,压强再增大,CO转化率提高不大,生成成本增大,得不偿失.
(4)工业上生产新能源二甲醚(CH3OCH3)的原理之一为:
2CO2(g)+6H2( g)?CH3OCH3(g)+3H2O(g).相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol•L1-)及正逆反应速率之间的关系如下表所示:
| 容器 | c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)和v(逆)大小比较 |
| I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v 正)< v(逆)(填>、<、=) |
(5)二甲醚(燃烧热为1455kJ/mol)燃料电池是一种绿色电池,其工作原理如图2所示,a、b均为惰性电极,a极的电极反应式为CH3OCH3-12e-+3H2O═2CO2↑+12H+;当消耗1molO2时,通过质子交换膜的质子数为4NA;
若电池工作时消耗1mol二甲醚所能产生的最大电能为1320kJ,则该燃料电池的工作效率为90.7% (燃料电池的工作效率是指电池所产生的最大电能与燃料燃烧时所能释放的全部热能之比).
5.燃烧某混合气体,所产生的CO2的质量一定大于燃烧相同质量丙烯所产生的CO2的质量,该混合气体是( )
| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
15.下列说法不正确的是( )
| A. | 0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+)=c(OH -)+2c(CO32-)+c(HCO3-) | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡 | |
| D. | 常温常压下能自发进行的反应,一定都是放热反应 |
2.下列有关物质结构的表述正确的是( )
| A. | 次氯酸的电子式  | B. | 氯化钠的分子式 NaCl | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 钠离子的结构示意图 |
19.氢、碳、氮、氧三种元素可组成许多重要的化合物.
(1)一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)△H<0达到平衡.其他条件不变时,下列措施能提高NO2转化率的是BC(填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ/mol-1
为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
此合成反应的a>0;△s>0,(填“>”、“<”或“=”)
(3)利用液氨合成尿素的反应在进行时分为如下两步.第一步:2NH3+CO2?H2NCOONH4,第二步:H2NCOONH4?H2O+H2NCONH2.在一体积为0.5L密闭容器中投入4.0mol液氨和1.0mol二氧化碳,实验测得反应中各组分随时间的变化如图1所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第2步反应决定,总反应进行到约55 min时到达平衡.
②反应进行到l0min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=0.148 mol/(L•min).
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图2:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.

(5)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
2NO2(g)?N2O4(g)△H=-56.9kJ•mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-810.1kJ/mol.
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.右图是通过光电转化原理以廉价原料制备新产品的示意图.写出上述光电转化过程的化学反应方程式2CO2+2H2O$\frac{\underline{\;光照\;}}{\;}$2HCOOH+O2.催化剂a、b之间连接导线上电子流动方向是a→b(填a→b或b→a).
(1)一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)△H<0达到平衡.其他条件不变时,下列措施能提高NO2转化率的是BC(填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ/mol-1
为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(3)利用液氨合成尿素的反应在进行时分为如下两步.第一步:2NH3+CO2?H2NCOONH4,第二步:H2NCOONH4?H2O+H2NCONH2.在一体积为0.5L密闭容器中投入4.0mol液氨和1.0mol二氧化碳,实验测得反应中各组分随时间的变化如图1所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第2步反应决定,总反应进行到约55 min时到达平衡.
②反应进行到l0min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=0.148 mol/(L•min).
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图2:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.

(5)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
2NO2(g)?N2O4(g)△H=-56.9kJ•mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-810.1kJ/mol.
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.右图是通过光电转化原理以廉价原料制备新产品的示意图.写出上述光电转化过程的化学反应方程式2CO2+2H2O$\frac{\underline{\;光照\;}}{\;}$2HCOOH+O2.催化剂a、b之间连接导线上电子流动方向是a→b(填a→b或b→a).
7.配制一定物质的量浓度的KOH溶液时,下列操作对实验结果没有影响的( )
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 定容加水超过刻度线又吸出少量 |