题目内容
3.已知可逆反应:X(g)+3Y(g)═2Z(g)△H<0,甲、乙为恒容、等体积的真空密闭容器,向甲中加入1molX和 3molY,在一定条件下达到平衡时放出热量为Q1KJ.在相同条件下,向乙容器中加入2molZ,达到平衡时吸收热量Q2KJ,已知 Q1=3Q2.下列叙述正确的是( )| A. | 平衡时甲、乙中Z的体积分数甲>乙 | |
| B. | 平衡时甲中X的转化率为75% | |
| C. | 达到平衡后,再向乙中加入0.25molX,0.75molY和1.5molZ,平衡向生成x的方向移动 | |
| D. | 乙中反应的热化学方程式:2Z(g)═X(g)+3Y(g)△H=+Q2kJ•mol-1 |
分析 由Q1=3Q2,可知△n甲(X)=3△n乙(X),设甲中A反应的物质的量为x,则乙中反应生成A物质的量为$\frac{x}{3}$,
甲 X(g)+3Y(g)═2Z(g)
起始(mol):1 3 0
转化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
乙中逆向进行 X(g)+3Y(g)═2Z(g)
起始(mol):0 0 2
转化(mol):$\frac{x}{3}$ x $\frac{2x}{3}$
平衡 (mol):$\frac{x}{3}$ x 2-$\frac{2x}{3}$
利用“一边倒法”,可知“1 mol X、3 mol Y”与“2 mol Z”是等效物料,它们在同温同容的条件下建立的平衡状态完全相同,则1-x=$\frac{x}{3}$,计算得到x=0.75,以此解答该题.
解答 解:由Q1=3Q2,可知△n甲(X)=3△n乙(X),设甲中A反应的物质的量为x,则乙中反应生成A物质的量为$\frac{x}{3}$,
甲 X(g)+3Y(g)═2Z(g)
起始(mol):1 3 0
转化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
乙中逆向进行 X(g)+3Y(g)═2Z(g)
起始(mol):0 0 2
转化(mol):$\frac{x}{3}$ x $\frac{2x}{3}$
平衡 (mol):$\frac{x}{3}$ x 2-$\frac{2x}{3}$
利用“一边倒法”,可知“1 mol X、3 mol Y”与“2 mol Z”是等效物料,它们在同温同容的条件下建立的平衡状态完全相同,则1-x=$\frac{x}{3}$,计算得到x=0.75,
A.两个平衡为等效平衡,故平衡时甲、乙中Z的体积分数甲=乙,故A错误;
B.平衡时甲中X的转化率为α(X)=$\frac{0.75}{1}$×100%=75%,故B正确;
C.利用“一边倒法”,可知再加入“0.25molX,0.75molY和1.5molZ,”与再加入“2 mol Z”等效,在恒温恒容条件下相当于增大压强,平衡向生成Z的方向移动,故C错误;
D.乙中反应掉的Z为 $\frac{2×0.75}{3}$=0.5mol,所给热化学方程式中2molZ对应的反应热应为+4Q2 kJ•mol-1,故D错误,
故选B.
点评 本题考查化学平衡的计算,难度较大.注意平衡三段式和等效平衡的应用,侧重学生的逻辑推理能力和发散思维能力的培养.

| A. | 温度相等、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H4 | ||
| C. | 体积相等、密度相等的CO和O2 | D. | 压强相等、体积相同的N2O和CO2 |
| A. | 3种 | B. | 6种 | C. | 9 种 | D. | 12种 |
(1)肼(N2H4)和化合物甲是一种重要的火箭推进剂,甲分子与肼分子具有相同的电子数,二者反应的生成物中有l0e-分子,另一种生成物为极稳定的单质,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O;
(2)对燃煤产生的尾气进行回收处理,有助于空气质量的改善,还能变废为宝,尾气处理过程中涉及到的主要反应如下:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1
③2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mol-1l
④2H2 (g)+O2 (g)=2H2O(g)△H=-483.6kJ•mol-1
S(g)与O2(g)反应生成SO2 (g)的热化学方程式为S(g)+O2(g)=SO2 (g)△H=-574kJ•mol-1.
(3)煤碳液化也有助于减少雾霾天气的发生,液化反应之一为:
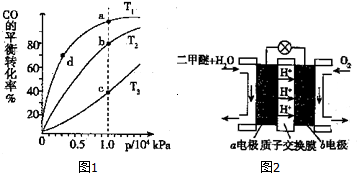
CO(g)+2H2(g)?CH3OH(g)△H<O;按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图1所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为v(d)<v(a)<v(b)<v(c);
实际生产条件控制在T1℃、1×l04kPa左右,选择此压强的理由是压强为1×l04kPa左右,CO的转化率已经很大,压强再增大,CO转化率提高不大,生成成本增大,得不偿失.
(4)工业上生产新能源二甲醚(CH3OCH3)的原理之一为:
2CO2(g)+6H2( g)?CH3OCH3(g)+3H2O(g).相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol•L1-)及正逆反应速率之间的关系如下表所示:
| 容器 | c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)和v(逆)大小比较 |
| I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v 正)< v(逆)(填>、<、=) |
(5)二甲醚(燃烧热为1455kJ/mol)燃料电池是一种绿色电池,其工作原理如图2所示,a、b均为惰性电极,a极的电极反应式为CH3OCH3-12e-+3H2O═2CO2↑+12H+;当消耗1molO2时,通过质子交换膜的质子数为4NA;
若电池工作时消耗1mol二甲醚所能产生的最大电能为1320kJ,则该燃料电池的工作效率为90.7% (燃料电池的工作效率是指电池所产生的最大电能与燃料燃烧时所能释放的全部热能之比).
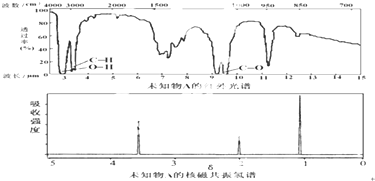
| A. | 由红外光谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 | |
| C. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C3H6O,则其结构简式为CH3COCH3 |
| A. | 0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+)=c(OH -)+2c(CO32-)+c(HCO3-) | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡 | |
| D. | 常温常压下能自发进行的反应,一定都是放热反应 |
| A. | 二氧化氮不是硝酸的酸酐 | |
| B. | 二氧化氮与水的反应是氧化还原反应 | |
| C. | 二氧化氮不是造成大气污染的气体之一 | |
| D. | 在通常状况下测得的NO2的相对分子质量是不准确的 |
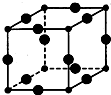 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.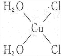 .
.