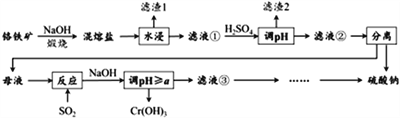
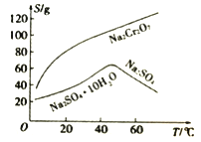
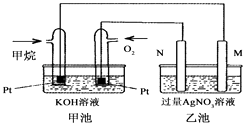
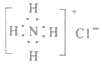题目内容
【题目】a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
【答案】C
【解析】a、b、c、d为短周期主族元素,由25℃时其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1) 的pH和原子序数的关系图可以知道, 0.1mol/LHNO3的pH=1, 0.1mol/LHClO4 的pH=1,0.1mol/LNaOH溶液的pH=13,a为N元素,b为Na,D为Cl,c为第三周期元素,且c的最高价含氧酸为二元酸时pH<1,则c应为S;由上述分析可以知道,a为N,b为Na,c为S,d为Cl;电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径:N3->Na+,A错误;S元素的氧化物有二氧化硫和三氧化硫,二氧化硫的水化物亚硫酸为弱酸,三氧化硫的水化物硫酸为强酸,B错误;非金属性Cl>S, 非金属性越强,氢化物越稳定,则氢化物稳定性: HCl>H2S,C正确;Na+为强碱阳离子,不发生水解,不能破坏水的电离平衡,S2-属于弱酸根离子,能够水解,破坏水的电离平衡,D错误;正确选项C。

练习册系列答案
相关题目