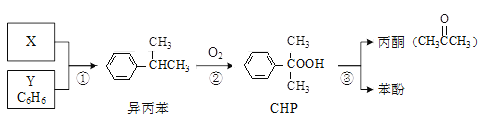
题目内容
【题目】常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
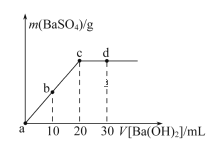
A.硫酸溶液的体积为25 mL
B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1
C.d时刻溶液中c(OH-)=0.05mol·L-1
D.溶液的导电能力:c<d<b<a
【答案】D
【解析】
A.硫酸和氢氧化钡溶液反应方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,二者以1:1反应,且c(H2SO4)=c[Ba(OH)2],二者完全反应时消耗的体积相等,根据图知,加入氢氧化钡20mL时二者恰好反应,所以V(H2SO4)=V[Ba(OH)2]=20mL,故A错误;
B.b时刻SO42-沉淀一半,体积变为原来的1.5倍,SO42-的浓度约为![]() mol/L=0.083molL-1,故B错误;
mol/L=0.083molL-1,故B错误;
C.d时刻Ba(OH)2过量,(OH-)=![]() mol/L=0.1mol/L,故C错误;
mol/L=0.1mol/L,故C错误;
D.b、d两点离子物质的量相等,但后者体积大,离子浓度小,导电性弱,导电能力c<d<b<a,故D正确;
故答案为D。

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目