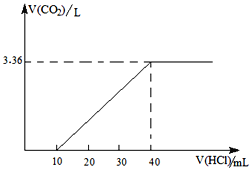
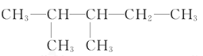
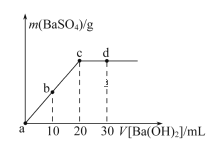
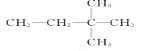题目内容
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:
CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:

(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量________(填“大于”“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:______。甲醇分子中的化学键类型是____(填“离子键”或“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是________,发生的是________(填“氧化”或“还原”)反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:_______。
(5)下列事实能表明该反应已达平衡状态的是________(填序号)。
A. CO2(g)的浓度不再发生变化
B. 单位时间内消耗1mol CO2的同时生成3mol H2
C. 在一个绝热的容器中,混合物的温度不再发生变化
D. 在一个容积固定的容器内,压强不再发生变化
【答案】小于 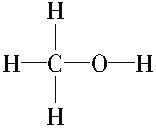 共价键 甲醇 氧化 升高温度、使用合适的催化剂、增大压强、增大反应物的浓度等 ABCD
共价键 甲醇 氧化 升高温度、使用合适的催化剂、增大压强、增大反应物的浓度等 ABCD
【解析】
(1)根据△H=反应物键能之和-生成物键能之和=生成物能量之和-反应物能量之和结合图像判断;
(2) 甲醇中C 原子形成四个共价键,H只有1个化学键,O形成2个化学键,结合乙醇的结构,写出甲醇的结构式;根据共价键和离子键的形成特点分析判断;
(3)燃料电池中燃料在负极发生氧化反应;
(4)根据影响化学反应速率的因素分析解答;
(5)根据平衡状态的判断依据:正逆反应速率相等、各组分浓度保持不变分析判断。
(1)根据图像,反应物能量高于生成物,反应放热,说明反应物的键能之和小于生成物的键能之和,即断裂反应物中的化学键吸收的总能量小于形成生成物中的化学键释放的总能量,故答案为:小于;
(2) 甲醇的结构类似于乙醇,C原子形成四个共价键,H只有1个化学键,O形成2个化学键,结合乙醇的结构可知甲醇的结构式为: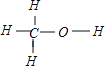 ;两种非金属元素的原子间形成的是共价键,故答案为:
;两种非金属元素的原子间形成的是共价键,故答案为: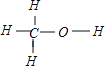 ;共价键;
;共价键;
(3) 新型甲醇燃料电池,电解质溶液是KOH溶液,负极上甲醇发生氧化反应,故答案为:甲醇;氧化;
(4)欲使反应CO2(g)+3H2 (g)CH3OH (g)+H2O(g)速率加快,可以通过升高温度、增大压强、加入适当的催化剂等等措施实现,故答案为:升高温度、使用合适的催化剂、增大压强、增大反应物的浓度等;
(5)A、CO2 (g)的浓度不再发生变化,说明反应达到平衡状态,故A正确;
B、单位时间内,消耗1mol CO2的同时生成3mol H2,说明正逆反应速率相等,反应达到了平衡状态,故B正确;
C、在一个绝热的容器中,温度不再变化,说明正逆反应速率相等,反应达到了平衡状态,故C正确;
D、在一个容积固定的容器内,该反应前后气体的体积不同,压强不变,说明各组分浓度不变,反应达到了平衡状态,故D正确;
故选ABCD。

【题目】碘及其化合物在生产生活中应用广泛。回答下列问题:
(1)单质碘与氟反应可得IF5,实验表明液态IF5具有一定的导电性原因在于IF5的自偶电离(如:2H2O![]() H3O++OH-),IF5的自偶电离方程式为_________
H3O++OH-),IF5的自偶电离方程式为_________
(2)亚硫酸钠和碘酸钾在酸性溶液中的反应是:Na2SO3+KIO3+H2SO4 →Na2SO4+K2SO4+I2+H2O(未配平)该反应过程和机理较复杂,一般认为分为以下步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+SO32-→IO-+SO42-(快)
③5I-+6H++I03-→3I2+3H2O(快)
④I2+SO32-+H2O-→2I+SO42-+2H+(快)
根据上述条件推测,此反应的总反应速率由_______步反应决定(填序号)。若预先加人淀粉溶液,由题述看必在_____________离子消耗完时,才会有淀粉变蓝的现象产生。
(3)离子的吸附是重要的研究课题
①已知SO2与I2的反应,速率极快且平衡常数大溶液中存在如下平衡:I2(aq)+l-(aq)=l3-(aq)现将1 mol SO2缓通入含1mol l2的水溶液中至恰好完全反应溶液中l3-的物质的量n(l3-)时间(t)的变化曲线如图1所示。开始阶段,n(l3-)逐渐增大的原因是_____
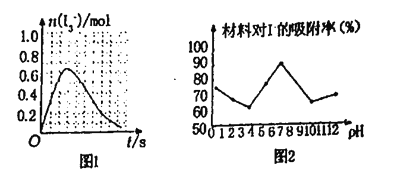
②科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附___________(填“酸性”“中性”或“碱性”)溶液中的I-。
③氯化银复合吸附剂也可有效吸附碘离子氯化银复合吸附剂对碘离子的吸附反应为:I-(aq)+AgCl(s)=Agl(s)+Cl-(aq),反应达到平衡后溶液中c(Cl-)=1.0mol·L-1.则溶液中c(I-)=______mol·L-1[k(AgCl)=2.0×10-10,k(Agl)=8.4×10-17]
(4)Fe3+与I-在溶液中发生反应:2Fe3++2I- ![]() 2Fe2++I2,该反应的正反应速率和Fe2+与I-的浓度关系为v=k·cm(I-)·cn(Fe3+)(其中k为常数)。T℃时,实验测得c(I-)、c(Fe3+)与反应速率的关系如下表:
2Fe2++I2,该反应的正反应速率和Fe2+与I-的浓度关系为v=k·cm(I-)·cn(Fe3+)(其中k为常数)。T℃时,实验测得c(I-)、c(Fe3+)与反应速率的关系如下表:
c(I-)/molL-1 | c(Fe3+)/molL-1 | v/molL-1s-1 | |
① | 0.20 | 0.80 | 0.032k |
② | 0.60 | 0.40 | 0.144k |
③ | 0.80 | 0.20 | 0.128k |
①在v=k·cm(I-)·cn(Fe3+)中m、n的值为_____________(填序号)
A.m=1n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
②I-浓度对反应速率的影响_____(填“大于”、“小于”或“等于”)Fe3+浓度对反应速率的影响。