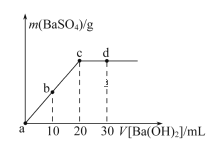
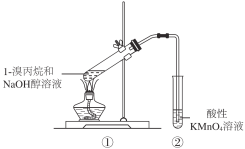
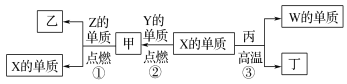
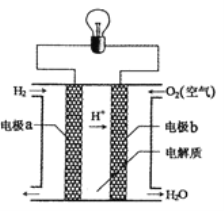
题目内容
【题目】现有下列十种物质:①AgCl②铜③液态醋酸④CO2⑤H2SO4⑥Ba(OH)2固体⑦NaHCO3⑧稀硝酸⑨熔融FeCl3 ⑩NaHSO4
(1)上述状态下可导电的是_________;(填序号,下同)属于强电解质的是________;属于非电解质的是______.
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为_______________________________
(3)用⑨的饱和溶液制备Fe(OH)3胶体的离子方程式_______________________ 足量的④通入⑥的溶液中的离子方程式______________;
【答案】②⑧⑨ ①⑤⑥⑦⑨⑩ ④ Ba(OH)2+2HNO3=Ba(NO3)2+2H2O Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ CO2+OH﹣=HCO3﹣
Fe(OH)3(胶体)+3H+ CO2+OH﹣=HCO3﹣
【解析】
(1)物质导电的原因是有自由移动的电子或自由移动的离子;在水溶液中或者熔化状态下能完全电离的是电解质属于强电解质,只能部分电离的属于弱电解质;在水溶液中和熔化状态下都不能导电的化合物属于非电解质,包括非金属氧化物、氨气和大多数有机物;
(2)H++OH-═H2O,表示可溶性强酸和可溶性强碱发生酸碱中和反应生成可溶性盐和水;
(3)加热时FeCl3水解生成Fe(OH)3胶体;当足量的二氧化碳通入氢氧化钡溶液中时生成碳酸氢钡。
(1)①AgCl中离子不能自由移动,故不能导电;在熔融状态下能完全电离,故为强电解质;②铜能导电;但铜是单质,故既不是电解质也不是非电解质;③液态醋酸中无自由移动的离子,故不能导电;但在水溶液中能部分电离,故为弱电解质;④CO2无自由移动的离子,故不能导电;在水溶液中导电和其本身无关,在熔融状态下不能导电,故为非电解质;⑤H2SO4中无自由移动的离子,故不能导电;但在水溶液中能完全电离,故为强电解质;⑥Ba(OH)2固体中无自由移动的离子,故不能导电;但在水溶液中和熔融状态下能完全电离,故为强电解质;⑦NaHCO3中无自由移动的离子,故不能导电;但在水溶液中能完全电离,故为强电解质;⑧稀硝酸有自由移动的离子,故能导电;但由于是混合物,故既不是电解质也不是非电解质;⑨熔融FeCl3中有自由移动的离子,故能导电;在水溶液中和熔融状态下能完全电离,故为强电解质;⑩NaHSO4中离子不能自由移动,故不能导电;但在水溶液中和熔融状态下能完全电离,故为强电解质;
故能导电的为②⑧⑨;是强电解质的是①⑤⑥⑦⑨;是非电解质的是④;
(2)离子方程式H++OH-═H2O表示可溶性强酸和可溶性强碱发生酸碱中和反应生成可溶性盐和水,故Ba(OH)2和HNO3的反应符合,化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(3)将饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,其水解方程式为Fe3++3H2O
Fe(OH)3(胶体)+3HCl,其水解方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;当足量的二氧化碳通入氢氧化钡溶液中时生成碳酸氢钡,离子方程式为CO2+OH-=HCO3-。
Fe(OH)3(胶体)+3H+;当足量的二氧化碳通入氢氧化钡溶液中时生成碳酸氢钡,离子方程式为CO2+OH-=HCO3-。

 全能练考卷系列答案
全能练考卷系列答案