题目内容
【题目】“异丙苯氧化法”生产丙酮和苯酚的合成路线如下,各反应的原子利用率均为100%。下列说法正确的是
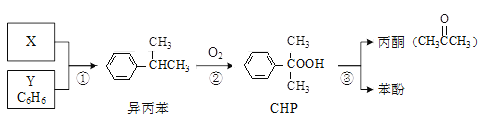
A. X的分子式为C3H8B. Y与异丙苯可用酸性KMnO4溶液鉴别
C. CHP与CH3COOH含有相同的官能团D. 可以用分液的方法分离苯酚和丙酮
【答案】B
【解析】
A.根据图示可知X和Y发生加成反应产生异丙苯,则X是丙烯,分子式是C3H6,A错误;
B.Y是苯与酸性KMnO4溶液不能反应,而异丙苯由于与苯环连接的C原子上含有H原子,可以被KMnO4溶液氧化而使溶液褪色,因此可以用KMnO4溶液鉴别二者,B正确;
C. CHP含有的官能团是-C-O-OH,而CH3COOH含有的官能团是羧基![]() ,所以二者的官能团不相同,C错误;
,所以二者的官能团不相同,C错误;
D.苯酚在室温下在水中溶解度不大,但容易溶于丙酮中,因此不能通过分液的方法分离,C错误;
故合理选项是B。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】碘及其化合物在生产生活中应用广泛。回答下列问题:
(1)单质碘与氟反应可得IF5,实验表明液态IF5具有一定的导电性原因在于IF5的自偶电离(如:2H2O![]() H3O++OH-),IF5的自偶电离方程式为_________
H3O++OH-),IF5的自偶电离方程式为_________
(2)亚硫酸钠和碘酸钾在酸性溶液中的反应是:Na2SO3+KIO3+H2SO4 →Na2SO4+K2SO4+I2+H2O(未配平)该反应过程和机理较复杂,一般认为分为以下步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+SO32-→IO-+SO42-(快)
③5I-+6H++I03-→3I2+3H2O(快)
④I2+SO32-+H2O-→2I+SO42-+2H+(快)
根据上述条件推测,此反应的总反应速率由_______步反应决定(填序号)。若预先加人淀粉溶液,由题述看必在_____________离子消耗完时,才会有淀粉变蓝的现象产生。
(3)离子的吸附是重要的研究课题
①已知SO2与I2的反应,速率极快且平衡常数大溶液中存在如下平衡:I2(aq)+l-(aq)=l3-(aq)现将1 mol SO2缓通入含1mol l2的水溶液中至恰好完全反应溶液中l3-的物质的量n(l3-)时间(t)的变化曲线如图1所示。开始阶段,n(l3-)逐渐增大的原因是_____
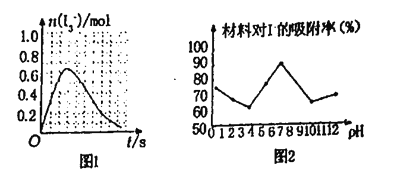
②科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附___________(填“酸性”“中性”或“碱性”)溶液中的I-。
③氯化银复合吸附剂也可有效吸附碘离子氯化银复合吸附剂对碘离子的吸附反应为:I-(aq)+AgCl(s)=Agl(s)+Cl-(aq),反应达到平衡后溶液中c(Cl-)=1.0mol·L-1.则溶液中c(I-)=______mol·L-1[k(AgCl)=2.0×10-10,k(Agl)=8.4×10-17]
(4)Fe3+与I-在溶液中发生反应:2Fe3++2I- ![]() 2Fe2++I2,该反应的正反应速率和Fe2+与I-的浓度关系为v=k·cm(I-)·cn(Fe3+)(其中k为常数)。T℃时,实验测得c(I-)、c(Fe3+)与反应速率的关系如下表:
2Fe2++I2,该反应的正反应速率和Fe2+与I-的浓度关系为v=k·cm(I-)·cn(Fe3+)(其中k为常数)。T℃时,实验测得c(I-)、c(Fe3+)与反应速率的关系如下表:
c(I-)/molL-1 | c(Fe3+)/molL-1 | v/molL-1s-1 | |
① | 0.20 | 0.80 | 0.032k |
② | 0.60 | 0.40 | 0.144k |
③ | 0.80 | 0.20 | 0.128k |
①在v=k·cm(I-)·cn(Fe3+)中m、n的值为_____________(填序号)
A.m=1n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
②I-浓度对反应速率的影响_____(填“大于”、“小于”或“等于”)Fe3+浓度对反应速率的影响。
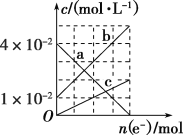
【题目】已知:AlO+HCO+H2O=Al(OH)3↓+CO![]() ,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2—)>c(OH) |
B | 0.01 | c(CO32—)+c(HCO3—)+c(H2CO3)=c(AlO2—) |
C | 0.015 | c(Na+)>c(CO32—)>c(OH)>c(HCO3—) |
D | 0.03 | c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+c(OH) |
A.AB.BC.CD.D