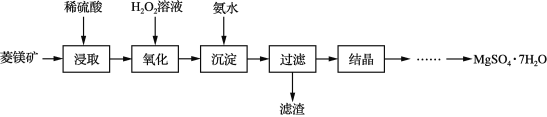
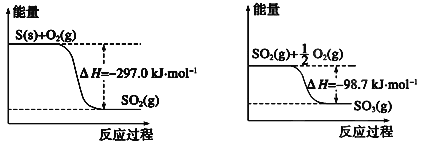
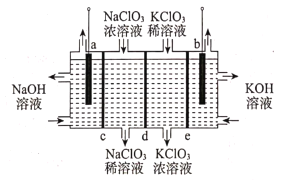
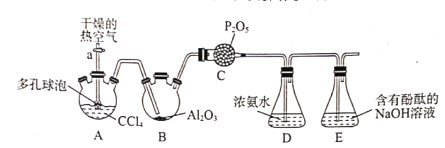
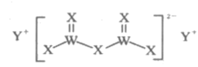
题目内容
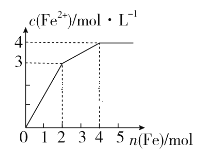
【题目】在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中Fe2(SO4)3与CuSO4的物质的量浓度之比为
A.3∶1B.1∶2C.2∶1D.1∶1
【答案】D
【解析】
氧化性Fe3+> Cu2+,Fe先与氧化性强的物质反应,即先发生Fe+2Fe3+=3Fe2+,然后是Fe+Cu2+= Fe2++Cu,由图象可知,加入2mol Fe时,Fe与溶液中Fe3+恰好完全反应,从2mol-4mol消耗2molFe,溶液中Fe2+的浓度增加了1mol/L,因此消耗的Cu2+的物质的量为1mol,以此计算。
氧化性Fe3+> Cu2+,加入Fe后会依次发生①Fe+2Fe3+=3Fe2+,②Fe+Cu2+= Fe2++Cu,由图象可知加入2mol Fe时,发生反应①时,生成Fe2+的物质的量为6mol,参与反应的Fe3+的物质的量为4mol,即Fe2(SO4)3的物质的量为2mol,在加入2mol Fe的基础上再加2mol Fe发生反应②,此时生成Fe2+的物质的量为2mol,原溶液中Cu2+的物质的量为2mol,即CuSO4的物质的量为2mol,因此该溶液中Fe2(SO4)3与CuSO4的物质的量浓度之比为2mol:2mol=1:1;
答案选D。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
【题目】用阳极 X 和阴极 Y 电解 Z 的水溶液,电解一段时间后,再加入 W,能使溶液恢复到电解前的 状态,则下列不符合题意的一组是
组号 | X | Y | Z | W |
A | C | Fe | NaCl | HCl 气体 |
B | Pt | Cu | CuSO4 | CuO |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3 |
A.AB.BC.CD.D