题目内容
【题目】已知下列反应的能量变化示意图。
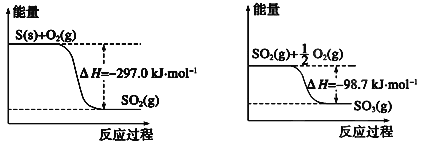
(1)1molS(g)与O2(g)完全反应生成SO2(g),反应的ΔH___-297.0kJ·mol-1(填“>”或“<”)
(2)写出S(s)与O2(g)反应生成SO3(g)的热化学方程式___。
【答案】< S(s)+![]() O2(g)=SO3(g) ΔH=-395.7kJ·mol-1
O2(g)=SO3(g) ΔH=-395.7kJ·mol-1
【解析】
(1)由左边图中可以看出,1molS(s)与O2(g)完全反应生成SO2(g),反应的ΔH=-297.0kJ·mol-1,S(g) 能量比S(s)高,则S(g)燃烧放出的能量比S(s)高。
(2)利用左、右两图分别写出两个反应的热化学方程式,然后利用盖斯定律求出S(s)与O2(g)反应生成SO3(g)的热化学方程式。
(1)由左边图中可以看出,1molS(s)与O2(g)完全反应生成SO2(g),反应的ΔH=-297.0kJ·mol-1,S(g) 能量比S(s)高,所以S(g)燃烧放出的能量比S(s)高,但由于ΔH为负值,因此1molS(g)与O2(g)完全反应生成SO2(g),反应的ΔH<-297.0kJ·mol-1。答案为:<;
(2)左、右两图表示的反应为S(s)+O2(g)=SO2(g) ΔH=-297.0kJ·mol-1,SO2(g)+![]() O2(g)
O2(g)
=SO3(g) ΔH=-98.7.0kJ·mol-1,两式相加得S(s)+![]() O2(g)=SO3(g) ΔH=-395.7kJ·mol-1。答案为:S(s)+
O2(g)=SO3(g) ΔH=-395.7kJ·mol-1。答案为:S(s)+![]() O2(g)=SO3(g) ΔH=-395.7kJ·mol-1。
O2(g)=SO3(g) ΔH=-395.7kJ·mol-1。

【题目】从镍钼矿渣(主要含有MoO3、NiO、MgO和Fe2O3)中提取元素,其主要工业流程如图:
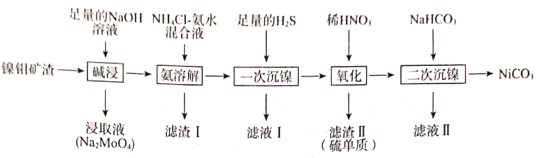
已知:①MoO3难溶于水,可溶于强碱溶液。
②Fe2O3、MgO不溶于NH4Cl—氨水混合液,NiO可溶于NH4Cl—氨水混合液生成[Ni(NH3)6]2+。
③已知部分金属离子形成氢氧化物沉淀的pH见下表:
pH(开始沉淀) | pH(完全沉淀) | |
Fe3+ | 1.52 | 3.18 |
Mg2+ | 8.10 | 9.43 |
请回答下列问题:
(1)“碱浸”时应先将镍钼矿渣粉碎,再与NaOH在80℃下反应2小时,该操作的目的为___。
(2)“碱浸”时,MoO3发生反应的离子方程式为___。
(3)“氨溶解”的目的为___,“氨溶解”过程中反应条件的选择性实验数据如图所示,“氨溶解”过程中需要控制温度在50~70℃之间,温度过高或过低都会导致产品的产量降低,请解释原因___。

(4)简述利用“滤渣I”制备纯净的铁红的方法:___。
(5)“一次沉镍”时加入H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为___。
(6)“氧化”时发生反应的氧化剂与还原剂的物质的量之比为___。
(7)“二次沉镍”时,发生反应的离子方程式为___。
(8)已知:某温度时,Ksp(NiC2O4)=4.0×10-10,Ksp(NiCO3)=1.60×10-8。此温度下,将碳酸镍固体投入到1L一定浓度的Na2C2O4溶液中,若要一次性恰好将1molNiCO3完全转化成NiC2O4,则所需Na2C2O4溶液的浓度c(Na2C2O4)=___(忽略溶液体积的变化)。
【题目】阅读下面信息,推断元素,按要求回答问题:
信息 | 问题 |
①短周期元素X、Y、Z、W,原子序数依次增大,最外层电子数均不少于最内层电子数 | (1)X一定不是__ A.氢 B.碳 C.氧 D.硫 |
②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中有铝元素吗?__ |
③向上述四种元素的单质的混合物中,加入足量的盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中有白色沉淀 | (3)白色沉淀的化学式为__ |
④向上述四种元素的单质的混合物中,加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中有白色沉淀 | (4)生成白色沉淀的离子方程式为__ |
⑤X与W同主族 | (5)X的最高价氧化物的电子式为___ |