题目内容
【题目】以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体(MgSO4·7H2O)的流程如下:
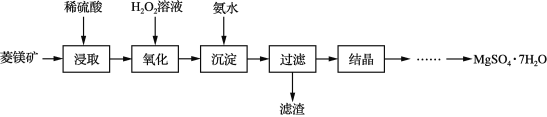
(1)“氧化”的过程目的是在酸性溶液中将Fe2+氧化为易被除去的离子,该过程发生反应的离子方程式是 _______________。
(2)“氧化”后的溶液与氨水反应生成的沉淀的化学式________,其颜色是_______。
(3)“过滤”所得滤液中含有的阳离子主要有______和______。
【答案】H2O2+2Fe2++2H+=2Fe3++2H2O Fe(OH)3 红褐色 ![]() Mg2+
Mg2+
【解析】
菱镁矿石(主要成分是MgCO3,并含有FeCO3和不溶性杂质)加稀硫酸浸取,过滤得到滤液为硫酸镁,硫酸亚铁溶液,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液pH沉淀铁离子,过滤得到滤液中含有MgSO4和氯化铵,浓缩结晶、过滤洗涤,得MgSO47H2O晶体,以此解答该题。
(1)硫酸亚铁、过氧化氢和硫酸反应生成硫酸铁和水,化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O,则发生反应的离子方程式是H2O2+2Fe2++2H+=2Fe3++2H2O;
(2)在含有Fe3+的溶液中滴加氨水,反应生成Fe(OH)3红褐色沉淀;
(3)加入氨水调节溶液pH沉淀Fe3+,过滤得到滤液中含有MgSO4和氯化铵,则所得滤液中含有的阳离子主要有![]() 和Mg2+。
和Mg2+。

【题目】维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
试剂 | pH | ||
初始 | 通入0.01 mol HCl气体 | 加入0.01 mol NaOH固体 | |
i.1 L H2O | 7 | a | 12 |
ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液 | 4.76 | 4.67 | 4.85 |
①a=____________(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:____________。
③试剂ii中微粒浓度关系正确的有____________(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是____________(填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
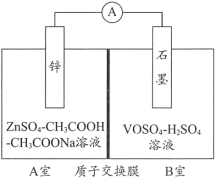
Zn+2VOSO4+2H2SO4![]() ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)____________(填“增大”“减小”或“不变”),结合化学用语说明理由:______。
②充电时,A室中的c(H+)变化缓慢的原因是____________。
【题目】工业上用![]() 和氨水的混合液浸取废铜矿渣中的单质铜,得到
和氨水的混合液浸取废铜矿渣中的单质铜,得到![]() 。某小组同学欲通过实验探究其原理。
。某小组同学欲通过实验探究其原理。
(查阅资料)i.![]() 呈深蓝色,
呈深蓝色,![]() ;受热易分解,放出氨气。
;受热易分解,放出氨气。
ii.![]() 在水溶液中不稳定,
在水溶液中不稳定,![]() 在溶液中只能以
在溶液中只能以![]() 等络合离子的形式稳定存在;
等络合离子的形式稳定存在;![]() 无色,易被氧气氧化为
无色,易被氧气氧化为![]() 。
。
(实验1)制备![]() 。
。
向盛有![]() 溶液的试管中滴加
溶液的试管中滴加![]() 氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到
氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到![]() 晶体。
晶体。
(1)资料表明,向![]() 溶液中滴加氨水,可能会生成浅蓝色
溶液中滴加氨水,可能会生成浅蓝色![]() 沉淀。
沉淀。
①该小组同学取实验1中浅蓝色沉淀,洗涤后,____________(补全实验操作和现象),证明沉淀中含有![]() 。
。
②补全实验1中生成![]() 沉淀的离子方程式:
沉淀的离子方程式:
![]() ____________+
____________+![]() ____________
____________
(2)甲同学设计实验证明深蓝色溶液中含![]() :加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
(实验2)探究用![]() 和氨水的混合液浸取单质铜得到
和氨水的混合液浸取单质铜得到![]() 的原理。
的原理。
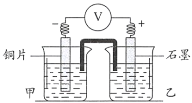
编号 | 实验装置及部分操作 | 烧杯中溶液 | 实验现象 |
2-1 |
实验开始,先读取电压表示数,后迅速将其换成电流表,继续实验, 10 min内记录甲烧杯中现象 | 甲: 乙: | 电压表指针迅速偏转至0.1V;甲中溶液无明显变化 |
2-2 | 甲: 乙: | 电压表指针迅速偏转至0.3V;甲中溶液无明显变化 | |
2-3 | 甲: 乙:溶液A | 电压表指针迅速偏转至0.35V;甲中溶液无明显变化 | |
2-4 | 甲: 乙: | 电压表指针迅速编转至0.65V;几分钟后,甲烧杯溶液逐渐由无色变蓝色 |
已知:其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大
(3)溶液A为____________。
(4)对比实验2-1和2-2,可以得到结论是____________。
(5)实验2-4中,甲烧杯中溶液由无色变为蓝色的原因是____________。
(6)依据上述实验,分析用![]() 和氨水的混合液浸取单质铜的原理:____________。
和氨水的混合液浸取单质铜的原理:____________。
【题目】已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
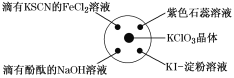
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变成蓝色 | Cl2具有氧化性 |
A.AB.BC.CD.D