题目内容
8.下列指定微粒的数目可能不等的是( )| A. | 等物质的量的氯气和液氯中含有的分子数 | |
| B. | 等质量的红磷和白磷中含有的原子数 | |
| C. | 同温、同体积的CO和NO的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
分析 A、氯气和液氯中含有的微粒只有分子;
B、红磷和白磷都是P原子构成的分子;
C、同温、同体积的CO和NO的物质的量无法计算,和压强有关系;
D、1mol铁和铝分别与足量氯气完全反应时转移电子均是3mol.
解答 解:A、氯气和液氯中含有的微粒只有分子,等物质的量的氯气和液氯中含有的分子数,故A不选;
B、红磷和白磷都是P原子构成的分子,质量一样,含有的原子数是一样的,故B不选;
C、同温、同体积的CO和NO的物质的量无法计算,还和压强有关系,所以含有的质子数无法比较,故C选;
D、1mol铁和铝分别与足量氯气完全反应时转移电子均是3mol,等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数是一样的,故D不选.
故选C.
点评 本题涉及物质的量、微粒数的有关计算,注意物质的微粒构成以及公式的灵活应用是关键,难度中等.

练习册系列答案
相关题目
19.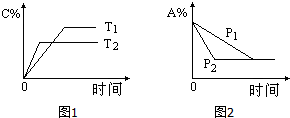 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
16.下列设计的实验方案能达到实验目的是( )
| A. | 制备O2:用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| B. | 提纯含有少量HCl的Cl2:将含有少量HCl的Cl2通入饱和的NaHCO3溶液和浓硫酸中净化气体 | |
| C. | 检验溶液中是否含有CO32-:向溶液中加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量的CO32- | |
| D. | 探究测定铝箔中氧化铝含量:取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(标准状况) |
3.下列有关实验的操作正确的是( )
| A. | 容量瓶可以用来溶解或稀释溶液 | |
| B. | 与硫酸铜溶液反应时可以取用大块的钠 | |
| C. | 可以用排饱和食盐水的方法收集氯气 | |
| D. | 制备氢氧化铁胶体时,需要不断加热和搅拌 |
13.室温下将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)═CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( )
| A. | △H2>△H3 | B. | △H1>△H3 | C. | △H1=△H2+△H3 | D. | △H1+△H2>△H3 |
20.下列叙述错误的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 | |
| B. | 1.6g甲烷完全燃烧生成二氧化碳和水,转移的电子数为0.8NA(NA为阿伏加德罗常数) | |
| C. | 1mol苯恰好与3mol H2完全加成,说明一个苯分子中有三个碳碳双键 | |
| D. | 烷烃的通式为CnH2n+2,则n=7,主链上有5个碳原子的烷烃共有五种 |
17.恒温下某密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,并达到平衡状态.下列说法中正确的是( )
| A. | 若容器体积不变,充入O2,平衡向右移动,O2的转化率一定增大 | |
| B. | 若容器体积不变,充入Ar,容器内压强增大,平衡向右移动 | |
| C. | 若容器体积不变,升高温度,平衡向左移动,平衡常数K减小 | |
| D. | 若容器压强不变,再充入1 mol SO2和0.5 mol O2,达到新平衡时c(SO2)增大 |
18.珍爱生命,远离毒品.以下是四种毒品的结构简式,下列有关说法正确的是( )
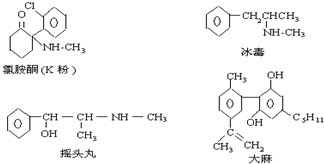

| A. | K粉的分子式为C13H17ClNO | |
| B. | 这四种毒品都属于芳香烃 | |
| C. | 摇头丸不可能发生加成反应 | |
| D. | 1mol大麻可与1mol Br2发生加成反应 |