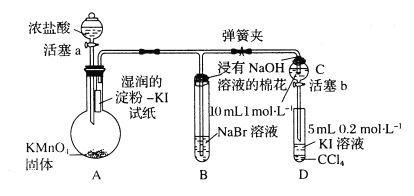
题目内容
【题目】下列物质在水溶液中的电离方程式错误的是
A. NaHCO3═Na++H++CO32- B. NaHSO4═Na++H++SO42-
C. MgCl2═Mg2++2Cl- D. Ba(OH)2═Ba2++2OH-
【答案】A
【解析】试题分析:A.碳酸氢钠是弱酸的酸式盐,电离方程式是NaHCO3═Na++HCO3-,错误;B.硫酸氢钠是强酸的酸式盐,应该都拆开,电离方程式是:NaHSO4═Na++H++SO42-,正确;C.氯化镁是盐,是强电解质,要写成离子形式,电离方程式是MgCl2═Mg2++2Cl-,正确;D.氢氧化钡是强碱,应该写成离子形式,电离方程式是:Ba(OH)2═Ba2++2OH-,正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】在2 L密闭容器内,充入一定量的NO和O2,800 ℃时发生反应2NO(g)+O2(g) ![]() 2NO2(g),n(NO)随时间的变化如表:
2NO2(g),n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应在1 s~2 s内,O2的物质的量减少________mol。
(2)如图所示,表示NO2变化曲线的是________。用O2表示从0~2s内该反应的平均速率v=________。
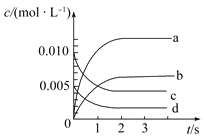
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变