��Ŀ����
����Ŀ����A��B��C��D��E5��Ԫ�أ����ǵĺ˵�������������Ҷ�С��20������C��E�ǽ���Ԫ�أ�A��E��ͬһ�壬����ԭ�ӵ����������Ų�Ϊns1 �� B��DҲ��ͬһ�壬����ԭ��������p�ܼ���������s�ܼ���������������Cԭ��������ϵ���������Dԭ��������ϵ�������һ�룮��ش��������⣺
��1��A�� �� B�� �� C�� �� D�� �� E�� ��
��2��B��C��D��E����Ԫ�صļ����Ӱ��뾶��С�����˳��Ϊ�������ӷ��ű�ʾ�� ��
��3��Ԫ��B��D�ĵ縺�ԵĴ�С��ϵ�� �� C��E�ĵ�һ�����ܵĴ�С��ϵ�� �� ���������������Ԫ�ط��ű�ʾ��
��4���ù����ʾʽ��ʾDԪ��ԭ�ӵļ۵����Ų� ��
��5��д��A��B��ԭ�Ӹ�����1��1�γɵĻ�����ĵ���ʽ ��
��6���õ���ʽ��ʾD��E�γ����ӻ�������γɹ��� ��
���𰸡�
��1��H��O��Al��S��K
��2��Al3+��O2����K+��S2��
��3��O��S��Al��K
��4��3s23p4
��5��![]()
��6��![]()
���������⣺A��B��C��D��E5�ֶ�����Ԫ�أ����ǵĺ˵�������������Ҷ�С��20��B��D��ͬһ�壬����ԭ��������p�ܼ���������s�ܼ������������������������Ų�Ϊns2np4 �� ��BΪOԪ�ء�DΪSԪ�أ�A��E��ͬһ�壬����ԭ�ӵ����������Ų�Ϊns1 �� ����IA�壬E��ԭ��������������5��Ԫ����ֻ��C��E�ǽ���Ԫ�أ���AΪHԪ�ء�EΪKԪ�أ�Cԭ��������ϵ���������Dԭ��������ϵ�������һ�룬������������Ϊ6�� ![]() =3����CΪAl����1��ͨ�����Ϸ���֪��A��B��C��D��E�ֱ���H��O��Al��S��KԪ�أ����Դ��ǣ�H��O��Al��S��K����2�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�����Ӳ���Խ�������Ӱ뾶Խ���������Ӱ뾶��С����˳����Al3+��O2����K+��S2�� �� ���Դ��ǣ�Al3+��O2����K+��S2������3��B��O��D��SԪ�أ�ͬһ����Ԫ�أ�Ԫ�صĵ縺������ԭ�������������С�����Ե縺��O��S��Ԫ�صĽ�����Խǿ�����һ������ԽС�����Ե�һ������Al��K�����Դ��ǣ�O��S��Al��K����4��D��SԪ�أ���3s��3p����Ϊ��۵��ӣ���Sԭ�Ӽ۵����Ų�ʽΪ3s23p4 �� ���Դ��ǣ�3s23p4����5��A��B��ԭ�Ӹ�����1��1�γɵĻ�������˫��ˮ��˫��ˮ�ĵ���ʽΪ
=3����CΪAl����1��ͨ�����Ϸ���֪��A��B��C��D��E�ֱ���H��O��Al��S��KԪ�أ����Դ��ǣ�H��O��Al��S��K����2�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�����Ӳ���Խ�������Ӱ뾶Խ���������Ӱ뾶��С����˳����Al3+��O2����K+��S2�� �� ���Դ��ǣ�Al3+��O2����K+��S2������3��B��O��D��SԪ�أ�ͬһ����Ԫ�أ�Ԫ�صĵ縺������ԭ�������������С�����Ե縺��O��S��Ԫ�صĽ�����Խǿ�����һ������ԽС�����Ե�һ������Al��K�����Դ��ǣ�O��S��Al��K����4��D��SԪ�أ���3s��3p����Ϊ��۵��ӣ���Sԭ�Ӽ۵����Ų�ʽΪ3s23p4 �� ���Դ��ǣ�3s23p4����5��A��B��ԭ�Ӹ�����1��1�γɵĻ�������˫��ˮ��˫��ˮ�ĵ���ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����6��D��S��E��KԪ�أ�����ͨ����ʧ�����γ����ӻ�������γɹ���Ϊ
����6��D��S��E��KԪ�أ�����ͨ����ʧ�����γ����ӻ�������γɹ���Ϊ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��

 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�����Ŀ��һ���¶��£���10 mL 0.40 mol��L-1 H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
������ʾ����Ӧ���������У�
��2Fe3++ H2O2 ![]() 2Fe2++O2��+2H+
2Fe2++O2��+2H+
�� H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
��Ӧ�����������仯����ͼ��ʾ������˵������ȷ����
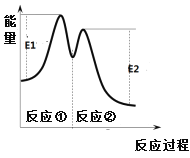
A. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2) = 3.33��10-2 mol��L-1��min-1
B. Fe3+�������Ǽӿ��������ķֽ�����
C. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
D. ��Ӧ2H2O2(aq)![]() 2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
2H2O(l) + O2(g)�ġ�H =E1-E2 < 0