题目内容
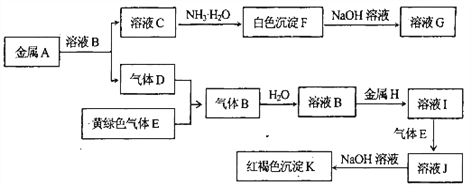
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
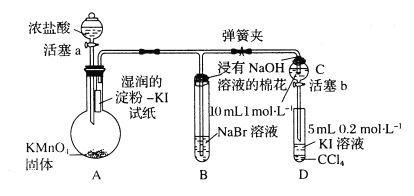
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为红棕色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体的化学反应方程式是___________。
(2)验证氯气的氧化性强于碘的实验现象是___________。
(3)B中溶液发生反应的离子方程式是___________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是___________,现象是___________。
(5)过程III实验的目的是___________。
【答案】 2KMnO4+16HCl=5Cl2↑+2KCl+2MnCl2+8H2O 湿润的淀粉-KI试纸变蓝 C12+2Br-=Br2+2Cl- 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置 CCl4层变为紫红色 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰
【解析】(1)A中产生黄绿色气体氯气的化学反应方程式是2KMnO4+16HCl=5Cl2↑+2KCl+2MnCl2+8H2O。(2)氯气具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,所以验证氯气的氧化性强于碘的实验现象是淀粉KI试纸变蓝。(3)氯元素的非金属性强于溴元素的非金属性,所以氯气能和溴化钠反应生成单质溴,反应的离子方程式是Cl2+2Br-=Br2+2Cl-。(4)由于C中有单质溴生成,所以要验证溴的氧化性强于碘,过程Ⅳ的操作和现象分别是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫红色。(5)由于氯气也能氧化碘化钾,干扰单质溴和碘化钾的反应,所以过程Ⅲ实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。

【题目】CoO是电子陶瓷所需的重要原料,工业上可用含有Co2O3、Fe2O3、Li和Al等物质的废料制备CoO。生产流程如下:
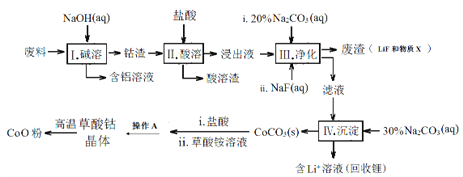
已知:① Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2 + ↑+ 3H2O,_______此反应的目的是_____________。
(2)步骤Ⅲ中加入Na2CO3溶液的作用是___________,物质X的化学式为___________。
(3)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是___________。
(4)将所得的草酸钴14.7g高温灼烧,其热重分析图如右图:
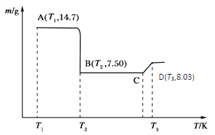
写出B点物质的化学式:___________,CD段发生反应的化学方程式为:_________________________。