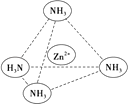
题目内容
【题目】能正确表示下列反应的离子方程式是( )
A. Fe3O4 溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B. 硫化钠的水解反应:S2-+H3O+![]() HS-+H2O
HS-+H2O
C. 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓
D. NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
【答案】C
【解析】A. 稀硝酸具有强氧化性,会将Fe2+氧化为Fe3+,因此Fe3O4与足量稀硝酸反应后的溶液中没有Fe2+,故A错误;B. 硫离子水解使溶液呈碱性,水解方程式为:S2-+H2O![]() HS-+OH-,故B错误;C. 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合,因氢氧根离子的量不足,铵根离子不反应,则离子方程式为:2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓,故C正确;D. 因Ba(OH)2过量,则NH4+会和OH-反应生成NH3·H2O,故D错误;答案选C。
HS-+OH-,故B错误;C. 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合,因氢氧根离子的量不足,铵根离子不反应,则离子方程式为:2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓,故C正确;D. 因Ba(OH)2过量,则NH4+会和OH-反应生成NH3·H2O,故D错误;答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
【题目】CoO是电子陶瓷所需的重要原料,工业上可用含有Co2O3、Fe2O3、Li和Al等物质的废料制备CoO。生产流程如下:
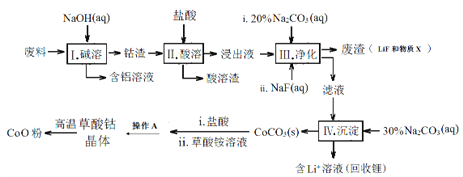
已知:① Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2 + ↑+ 3H2O,_______此反应的目的是_____________。
(2)步骤Ⅲ中加入Na2CO3溶液的作用是___________,物质X的化学式为___________。
(3)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是___________。
(4)将所得的草酸钴14.7g高温灼烧,其热重分析图如右图:
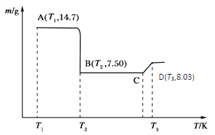
写出B点物质的化学式:___________,CD段发生反应的化学方程式为:_________________________。