题目内容
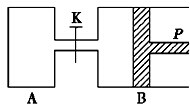 如图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.下列说法错误的是( )
如图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.下列说法错误的是( )| A、B中X的转化率为75% |
| B、A中X的转化率比B中的低 |
| C、平衡时A中混合气体密度比B小 |
| D、打开K,一段时间后反应再次达到平衡,则B的体积为1.2a L |
考点:化学平衡的计算,化学平衡建立的过程
专题:化学平衡专题
分析:根据图象知,A保持恒容,B保持恒压,
A、因为B容器中是恒压过程,利用三段式,根据体积之比等物质的量之比,可以求得参加反应的X的物质的量,再求得X的转化率;
B、起始时,VA=a L,VB=0.8a L,而充入的A、B是相同的,所以在B中压强始终比A的大,反应正向进行的程度大,据此判断X的转化率;
C、A、B两容器中气体的质量始终相等,根据反应后两容器的体积大小可比较出密度大小;
D、打开K达新平衡等效为B中到达的平衡,根据X的转化率计算平衡后总的物质的量,再根据体积之比等于物质的量之比计算总体积,进而计算B容器的体积,据此判断;
A、因为B容器中是恒压过程,利用三段式,根据体积之比等物质的量之比,可以求得参加反应的X的物质的量,再求得X的转化率;
B、起始时,VA=a L,VB=0.8a L,而充入的A、B是相同的,所以在B中压强始终比A的大,反应正向进行的程度大,据此判断X的转化率;
C、A、B两容器中气体的质量始终相等,根据反应后两容器的体积大小可比较出密度大小;
D、打开K达新平衡等效为B中到达的平衡,根据X的转化率计算平衡后总的物质的量,再根据体积之比等于物质的量之比计算总体积,进而计算B容器的体积,据此判断;
解答:
解:根据图象知,A保持恒容,B保持恒压,
A、因为B容器中是恒压过程,利用三段式,根据体积之比等物质的量之比,可以求得参加反应的X的物质的量,再求得X的转化率;
设反应转化了的X的物质的量为mmol,则:
3X(g)+3Y(g 2Z(g)+2W(g)
2Z(g)+2W(g)
起始(mol) 2 2 0 0
反应(mol) m m
m
m
平衡(mol) 2-m 2-m
m
m
即
=
,解得:m=1.5,所以X物质的转化率
100%=75%,故A正确;
B、起始时,VA=a L,VB=0.8a L,而充入的A、B是相同的,所以在B中压强始终比A的大,反应正向进行的程度大,所以B中的X的转化率大于A中X的转化率,故B正确;
C、A、B两容器中气体的质量始终相等,根据题中条件可知,反应后B容器的体积比A容器的体积小,所以B中的密度大于A中的密度,故C正确;
D、打开K达新平衡等效为B中到达的平衡,X的转化率为75%,参加反应的X的总的物质的量为4mol×75%=3mol,
3X(g)+3Y(g 2Z(g)+2W(g)
2Z(g)+2W(g)
起始(mol) 4 4 0 0
反应(mol) 3 3 2 2
平衡(mol) 1 1 2 2
故平衡后容器内总的物质的量为1mol+1mol+2mol+2mol=6mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为
×6mol=1.2aL,则VB=1.2aL-aL=0.2aL,故D错误;
故选D.
A、因为B容器中是恒压过程,利用三段式,根据体积之比等物质的量之比,可以求得参加反应的X的物质的量,再求得X的转化率;
设反应转化了的X的物质的量为mmol,则:
3X(g)+3Y(g
 2Z(g)+2W(g)
2Z(g)+2W(g) 起始(mol) 2 2 0 0
反应(mol) m m
| 2 |
| 3 |
| 2 |
| 3 |
平衡(mol) 2-m 2-m
| 2 |
| 3 |
| 2 |
| 3 |
即
2-m+2-m+
| ||||
| 2+2 |
| 0.6a |
| 0.8a |
| 1.5 |
| 2 |
B、起始时,VA=a L,VB=0.8a L,而充入的A、B是相同的,所以在B中压强始终比A的大,反应正向进行的程度大,所以B中的X的转化率大于A中X的转化率,故B正确;
C、A、B两容器中气体的质量始终相等,根据题中条件可知,反应后B容器的体积比A容器的体积小,所以B中的密度大于A中的密度,故C正确;
D、打开K达新平衡等效为B中到达的平衡,X的转化率为75%,参加反应的X的总的物质的量为4mol×75%=3mol,
3X(g)+3Y(g
 2Z(g)+2W(g)
2Z(g)+2W(g) 起始(mol) 4 4 0 0
反应(mol) 3 3 2 2
平衡(mol) 1 1 2 2
故平衡后容器内总的物质的量为1mol+1mol+2mol+2mol=6mol,气体的体积之比等于气体的物质的量之比,则总容器的体积为
| 0.8aL |
| 4mol |
故选D.
点评:本题主要考查学生化学平衡的有关计算以及化学平衡移动的有关知识,注意打开K达新平衡等效为A中到达的平衡是解题关键,难度大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol CH3+(碳正离子)中含有电子数为10NA |
| B、常温常压下,17g NH3中含有原子数4NA |
| C、常温常压下,22.4L水中含有的共价键数为2NA |
| D、在密闭容器中,1mol N2与3mol H2在一定条件下充分反应,生成氨气的分子数为2NA |
在下列自然资源的开发利用中,说法不正确的是( )
| A、通过石油的分馏可以获得汽油、煤油和柴油 |
| B、含C18以上的烷烃的重油经过催化裂化可以得到汽油 |
| C、煤中含有苯和甲苯,可以先用干馏后用分馏的方法把它们分离出来 |
| D、煤是由无机物和有机物组成的复杂的混合物 |
通常把铝粉与某些金属氧化物的混合物称为铝热剂,下列氧化物中不能与铝粉发生铝热反应的是( )
| A、Na2O |
| B、Fe3O4 |
| C、MnO2 |
| D、V2O5 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、含1mol FeCl3的饱和溶液用于制取Fe(OH)3胶体,则胶体粒子一定为NA个 |
| B、100mL 18.4mol?L-1硫酸与足量铜反应,生成SO2的分子数为0.92NA |
| C、1L 1mol/L的K2CO3溶液中离子总数小于3NA |
| D、室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
对于反应NaH+NH3═H2+NaNH2的叙述正确的是( )
| A、是一个置换反应 |
| B、是一个复分解反应 |
| C、氧化产物和还原产物都是H2 |
| D、还原剂是NH3 |
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH?CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
CH3COOH?CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
| A、对混合溶液进行微热,K1增大、K2减小 |
| B、混合溶液的pH<7 |
| C、混合溶液中c(CH3COO-)>c(Na+) |
| D、温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
已知CH3CH═CHCH3
2CH3CHO,则化学式为C5H10的烯烃在此条件下可生成醛的种类为( )
| [O] |
| A、5种 | B、4种 | C、3种 | D、6种 |
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、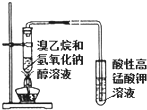 用此装置可以验证溴乙烷发生了消去反应 |
B、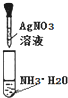 用此装置配制银氨溶液 |
C、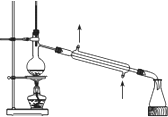 用装置提纯工业乙醇 |
D、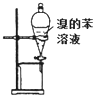 用装置萃取溴水中的溴,并把溴的苯溶液从下口放出 |