题目内容
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、含1mol FeCl3的饱和溶液用于制取Fe(OH)3胶体,则胶体粒子一定为NA个 |
| B、100mL 18.4mol?L-1硫酸与足量铜反应,生成SO2的分子数为0.92NA |
| C、1L 1mol/L的K2CO3溶液中离子总数小于3NA |
| D、室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氢氧化铁胶粒为氢氧化铁的聚集体,氢氧化铁胶粒的物质的量一定需要1mol;
B.随着反应的进行,浓硫酸变成稀硫酸后,反应停止,反应生成的二氧化硫的物质的量减少;
C.碳酸根离子部分水解,导致溶液中阴离子的数目增多;
D.乙烯和丙烯的最简式为CH2,根据最简式计算出混合物中含有的碳原子数目.
B.随着反应的进行,浓硫酸变成稀硫酸后,反应停止,反应生成的二氧化硫的物质的量减少;
C.碳酸根离子部分水解,导致溶液中阴离子的数目增多;
D.乙烯和丙烯的最简式为CH2,根据最简式计算出混合物中含有的碳原子数目.
解答:
解:A.含1mol FeCl3的饱和溶液用于制取Fe(OH)3胶体,由于氢氧化铁胶粒为氢氧化铁的聚集体,所以氢氧化铁胶粒小于1mol,胶体粒子数小于NA个,故A错误;
B.100mL 18.4mol?L-1硫酸中含有硫酸1.84mol,消耗1.84mol硫酸能够生成0.92mol二氧化硫,由于随着反应的进行,浓硫酸会变成稀硫酸,稀硫酸与铜不发生反应,所以反应生成的二氧化硫小于0.92mol,生成SO2的分子数小于0.92NA,故B错误;
C. 1L 1mol/L的K2CO3溶液中含有溶质碳酸钾1mol,由于碳酸根离子水解使溶液中阴离子数目增多,所以溶液中阴离子大于1mol,离子总物质的量大于3mol,离子总数大于3NA,故C错误;
D.42.0g乙烯和丙烯的混合气体中含有3mol最简式CH2,含有3molC原子,含有的碳原子数为3NA,故D正确;
故选D.
B.100mL 18.4mol?L-1硫酸中含有硫酸1.84mol,消耗1.84mol硫酸能够生成0.92mol二氧化硫,由于随着反应的进行,浓硫酸会变成稀硫酸,稀硫酸与铜不发生反应,所以反应生成的二氧化硫小于0.92mol,生成SO2的分子数小于0.92NA,故B错误;
C. 1L 1mol/L的K2CO3溶液中含有溶质碳酸钾1mol,由于碳酸根离子水解使溶液中阴离子数目增多,所以溶液中阴离子大于1mol,离子总物质的量大于3mol,离子总数大于3NA,故C错误;
D.42.0g乙烯和丙烯的混合气体中含有3mol最简式CH2,含有3molC原子,含有的碳原子数为3NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意稀硫酸不与铜发生反应;选项D注意使用二者的最简式进行计算;有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
下列说法正确的是( )
| A、晶体的分子间作用力越大,分子越稳定 |
| B、HCl气体和NaCl固体分别溶于水形成溶液的过程中均破坏了化学键 |
| C、其水溶液能导电的化合物一定是离子化合物 |
| D、由非金属元素组成的化合物一定是共价化合物 |
下列化学方程式正确的是( )
| A、CH3COONa+CO2+H2O→CH3COOH+NaHCO3 |
B、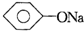 +CO2+H2O→ +CO2+H2O→ +NaHCO3 +NaHCO3 |
C、2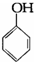 +3Br2→ +3Br2→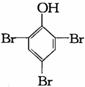 ↓ ↓ |
D、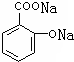 +2CO2+2H2O→ +2CO2+2H2O→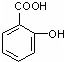 +2NaHCO3 +2NaHCO3 |
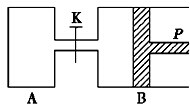 如图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.下列说法错误的是( )
如图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.下列说法错误的是( )| A、B中X的转化率为75% |
| B、A中X的转化率比B中的低 |
| C、平衡时A中混合气体密度比B小 |
| D、打开K,一段时间后反应再次达到平衡,则B的体积为1.2a L |
某种有机物如图所示,有关该物质的说法正确的是( )
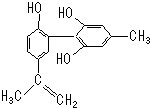

| A、由于酚酸性比碳酸弱,故此物质不可能与碳酸钠溶液反应 |
| B、滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C、1mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4mol、7mol |
| D、该分子中的所有原子可能共平面 |
下列变化中,由氧化反应引起的是( )
| A、乙烯通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色 |
| B、在一定条件下,苯与氢气反应生成环己烷 |
| C、在一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成 |
| D、在催化剂作用下,乙烯分子间发生加成聚合反应生成高分子聚乙烯 |
反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在密闭容器中进行,下列是四种不同条件下的反应速率,其中化学反应速率最快的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|