题目内容
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险.如图是氟离子电池工作示意图,其中充电时 F-从乙电极流向甲电极,下列关于该电池的说法正确的是
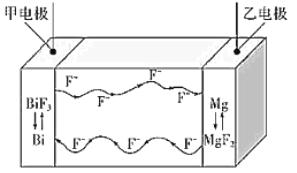
A.放电时,甲电极的电极反应式为 Bi-3e-+3F-=BiF3
B.充电时,导线上每通过1 mol e-,甲电极质量增加 19 g
C.放电时,乙电极电势比甲电极高
D.充电时,外加电源的正极与乙电极相连
【答案】B
【解析】
充电时F-从乙电极流向甲电极,则充电时,甲电极为电解池的阳极,电极反应式为Bi+3F- -3e-═BiF3,乙电极为阴极,反应式为MgF2+2e-═Mg+2F-,又充电时,电解池的阳极、阴极与原电池的正极、负极对应,所以放电时,乙电极为负极,Mg失去电子结合F-生成MgF2,电极反应式为Mg+2F--2e-═MgF2,甲电极为正极,正极反应式为BiF3+3e-═Bi+3F-,据此分析解答。
A.放电时,甲为正极,正极的反应式为BiF3+3e-═Bi+3F-,故A错误;
B.充电时,甲电极为阳极,电极反应式为Bi+3F- -3e-═BiF3,所以导线上每通过1mol e-,增加1molF-,则甲电极质量增加1mol×19g/mol=19g,故B正确;
C.放电时,乙电极为负极,甲为正极,所以乙电极电势比甲电极低,故C错误;
D.充电时,外加电源的正极与甲电极相连,故D错误;
故选B。

【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程:
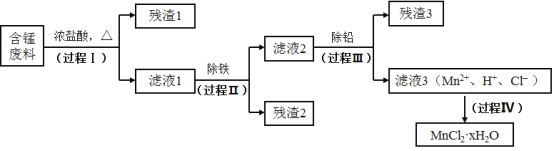
资料a.Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是_____________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成;另取少量滤液1于试管中,_____________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.......
写出c的离子方程式:_____________。
(2)过程Ⅱ的目的是除铁。有如下两种方法:
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物......。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②补全ⅱ中的操作:_____________。
③两种方法比较,氨水法除铁的缺点是_____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是_____________。
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=_____________。