题目内容
【题目】碱式氯化铜[Cux(OH)yClz·mH2O]是重要的农药、医药中间体,还可用作木材防腐剂、饲料添加剂等.研究小组在实验室用某厂废铜渣(主要成分为 Cu、CuO,含少量 Fe3O4、Ni、Al2O3)制备碱式氯化铜的流程如下,回答下列问题:
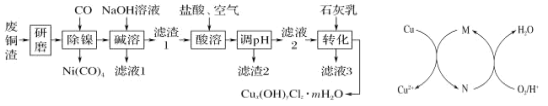
(1)“研磨”的目的为________。
(2)“碱溶”的目的为____________。
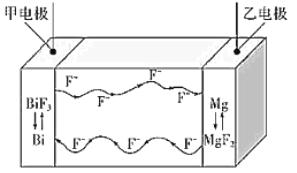
(3)“酸溶”时生成 Fe3+反应的离子方程式为_______;生成的 Fe3+对 Cu 发生的氧化反应的催化原理如上图所示。N 代表的物质为________(填化学式或离子符号)。
(4)“酸溶”时温度不能过高的理由为_________。
(5)若滤液 2 中 c(Fe3+)=4×10-8 mol/L,pH=4,则 Ksp[Fe(OH)3]=__________。
(6)为测定 Cux(OH)yClz·mH2O 的组成,进行如下操作:取样品 23.25 g,用适量酸溶解后配成 100mL 溶液;取 10.00 mL 溶液加入足量 AgNO3 溶液,生成 1.435 g 沉淀;另取 10.00 mL 溶液,用 1.000 mol/L的 EDTA 标准液滴定 Cu2+(Cu2+与 EDTA 以物质的量之比 1∶1 反应),滴定至终点时消耗标准液体积为 20.00 mL。
①溶解样品所用酸的化学式为________;
②最终确定该样品的化学式为______。
【答案】加快反应速率,使反应更充分 将氧化铝转化为偏铝酸钠而分离除去 4Fe3O4+O2+36H+=12Fe3++18H2O Fe2+或FeCl2 温度过高,盐酸挥发程度增大,空气溶解度减小,导致反应速率降低,酸溶不充分 4×10-38 HNO3 Cu2(OH)3ClH2O
【解析】
由图可知,废铜渣(主要成分Cu、CuO,含少量Fe3O4、Ni、A12O3)研磨可增大接触面积,加快反应速率,通入CO除去Ni元素,加NaOH分离出的滤液1中含偏铝酸钠和NaOH,滤渣1含Cu、CuO、Fe3O4,加盐酸、空气溶解后得到含铜离子、铁离子的溶液,调节pH,过滤分离出的滤渣2为Fe(OH)3,滤液2中加石灰乳可制备碱式氯化铜Cux(OH)yClzmH2O,滤液3中含氯化钙,据此分析解答。
(l)“研磨”可增大反应物的接触面积,加快反应速率,使反应更充分,故答案为:加快反应速率,使反应更充分;
(2)“碱溶”的目的是将氧化铝转化为偏铝酸钠分离除去,故答案为:将氧化铝转化为偏铝酸钠分离除去;
(3)“酸溶”时生成Fe3+反应的离子方程式为4Fe3O4+O2+36H+=12Fe3++18H2O;生成的Fe3+对Cu发生的氧化反应的催化原理图中,Cu失去电子,则Fe得到电子转化为N的化学式为Fe2+或FeCl2,故答案为:4Fe3O4+O2+36H+=12Fe3++18H2O;Fe2+或FeCl2;
(4)“酸溶”时温度不能过高,因为温度过高,盐酸挥发程度增大,空气的溶解度减小,会导致反应速率降低,酸溶不充分,故答案为:温度过高,盐酸挥发程度增大,空气的溶解度减小,导致反应速率降低,酸溶不充分;
(5)若滤液2中c(Fe3+)=4×10-8mol/L,pH=4,则Ksp[Fe(OH)3]=4×10-8×(10-10)3=4×10-38,故答案为:4×10-38;
(6)①后续实验需要加入AgNO3 溶液,因此溶解样品所用酸为HNO3,加入足量AgNO3溶液可检验Cl-,故答案为:HNO3;
②n(Cl-)=![]() ×
×![]() =0.1mol,n(Cu2+)=0.02L×1mol/L×
=0.1mol,n(Cu2+)=0.02L×1mol/L×![]() =0.2mol,由电荷守恒可知n(OH-)=2n(Cu2+)-n(Cl-)=0.2 mol×2-0.1 mol=0.3mol,m(Cl-)=0.1mol×35.5 gmol-1=3.55 g,m(Cu2+)=0.2mol×64 gmol-1=12.8g,m(OH-)=0.3mol×17g/mol=5.1 g,n(H2O)=
=0.2mol,由电荷守恒可知n(OH-)=2n(Cu2+)-n(Cl-)=0.2 mol×2-0.1 mol=0.3mol,m(Cl-)=0.1mol×35.5 gmol-1=3.55 g,m(Cu2+)=0.2mol×64 gmol-1=12.8g,m(OH-)=0.3mol×17g/mol=5.1 g,n(H2O)=![]() =0.1mol,则x∶y∶z∶m=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=
=0.1mol,则x∶y∶z∶m=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=