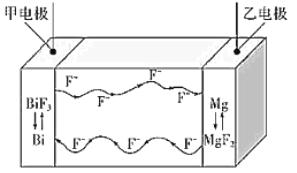
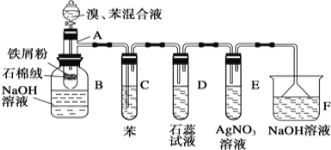
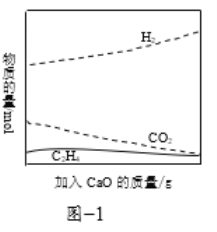
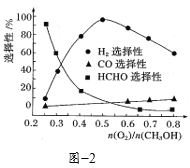
题目内容
【题目】根据如下能量关系示意图,下列说法正确的是
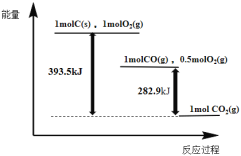
A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B.由C→CO的热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH= 221.2 kJmol1
C.反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量
D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH
【答案】B
【解析】
A.据图可知1 mol C(s)与1 mol O2(g)的能量之和比1molCO2(g)的能量多393.5kJ,并不是1 mol C(s)与1 mol O2(g)的能量之和为393.5kJ,故A错误;
B.据图可知:
i:C(s)+O2(g)=CO2(g) ΔH=393.5kJ/mol;
ii:CO(g)+![]() O2(g)=CO2(g) ΔH=282.9kJ/mol;
O2(g)=CO2(g) ΔH=282.9kJ/mol;
由盖斯定律(i- ii)×2可得2C(s)+O2(g)=2CO(g)的ΔH=[393.5kJ/mol(282.9kJ/mol)] ×2=221.2 kJmol1,故B正确;
C.据图可知1molCO(g)和0.5molO2(g)的能量高于1mol CO2(g),即反应物的总能量大于生成物的总能量,故C错误;
D.1 mol C(s)磨成粉末后,反应更加剧烈,但不能改变反应的焓变,故D错误;
故答案为B。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目