题目内容
【题目】甲醇是一种基础化工原料,可以用多种方法合成。
(1)用CO2生产甲醇。
已知:①CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
②2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1; (a、b均>0)
则表示CH3OH(g)燃烧的热化学方程式为:____________。
要使反应①在一定条件下建立的平衡逆向移动,可采取的措施有_______(填写字母序号)。
a.缩小反应容器的容积
b.扩大反应容器的容积
c.升高温度
d.使用合适的催化剂
e.从平衡体系中及时分离出CH3OH
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ![]() CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
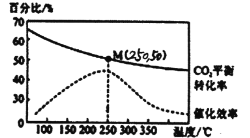
(3)CO2在工业上有多种用途,其中之一是合成低碳烯烃。在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和 CO2平衡转化率的影响如图所示:
C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和 CO2平衡转化率的影响如图所示:
①图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是__________。
②250 ℃时,该反应的平衡常数K值为__________。
【答案】2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ΔH =+(2a -3b)kJ·mol-1 bc < > B △H<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低 1
【解析】
(1)根据盖斯定律分析书写CH3OH(g)燃烧的热化学方程式;对于反应①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H=-akJmol-1,正反应为气体体积减小的放热反应,根据平衡移动的原理分析解答;
CH3OH(g)+H2O(l)△H=-akJmol-1,正反应为气体体积减小的放热反应,根据平衡移动的原理分析解答;
(2)①由达到平衡所需要的时间长短知,T1<T2,据此分析判断;②正反应是放热反应,根据温度对平衡移动的影响分析解答;③CO(g)+2H2(g) ![]() CH3OH(g) △H<0,结合平衡移动的影响因素分析解答;
CH3OH(g) △H<0,结合平衡移动的影响因素分析解答;
(3)①2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-128kJ/mol,根据温度对平衡移动的影响分析解答;②根据三段式分析解答。
C2H4(g)+4H2O(g)△H=-128kJ/mol,根据温度对平衡移动的影响分析解答;②根据三段式分析解答。
(1)①CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=-akJmol-1,②2H2(g)+O2(g)═2H2O(l) △H=-bkJmol-1;根据盖斯定律,将3×②-2×①得:2CH3OH(g)+3O2(g) = 2CO2(g)+4H2O(l) △H=+(2a-3b)kJmol-1,所以CH3OH(g)燃烧的热化学方程式为:2CH3OH(g)+3O2(g) = 2CO2(g)+4H2O(l) △H=+(2a-3b)kJmol-1;对于反应①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H=-akJmol-1,正反应为气体体积减小的放热反应。a.正反应为气体体积减小的反应,缩小反应容器的容积,压强增大,平衡正向移动,故a错误;b.正反应为气体体积减小的反应,扩大反应容器的容积,压强减小,平衡逆向移动,故b正确;c.正反应为放热反应,升高温度,平衡逆向移动,故c正确;d.使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故d错误;e.从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故e错误;故选bc,故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H=+(2a-3b)kJmol-1;bc;
CH3OH(g)+H2O(l) △H=-akJmol-1,正反应为气体体积减小的放热反应。a.正反应为气体体积减小的反应,缩小反应容器的容积,压强增大,平衡正向移动,故a错误;b.正反应为气体体积减小的反应,扩大反应容器的容积,压强减小,平衡逆向移动,故b正确;c.正反应为放热反应,升高温度,平衡逆向移动,故c正确;d.使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故d错误;e.从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故e错误;故选bc,故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H=+(2a-3b)kJmol-1;bc;
(2)①由达到平衡所需要的时间长短知,T1<T2,当温度由T2→T1(降温)时,CO的转化率增大,说明降低温度,平衡向右移动,故正反应是放热反应,△H<0,故答案为:<;
②正反应是放热反应,升高温度,平衡逆向移动,K减小,所以K1>K2,故答案为:>;
③CO(g)+2H2(g) ![]() CH3OH(g) △H<0。A.升高温度,平衡逆向移动,所以甲醇产率降低,故错误;B.将CH3OH(g)从体系中分离,平衡正向移动,甲醇产率增大,故正确;C.使用合适的催化剂平衡不移动,甲醇产率不变,故错误;D.充入He,使体系总压强增大,各组分的浓度不变,平衡不移动,甲醇产率不变,故错误;故选B;
CH3OH(g) △H<0。A.升高温度,平衡逆向移动,所以甲醇产率降低,故错误;B.将CH3OH(g)从体系中分离,平衡正向移动,甲醇产率增大,故正确;C.使用合适的催化剂平衡不移动,甲醇产率不变,故错误;D.充入He,使体系总压强增大,各组分的浓度不变,平衡不移动,甲醇产率不变,故错误;故选B;
(3)①2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-128kJ/mol,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低,故答案为:△H<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低;
C2H4(g)+4H2O(g)△H=-128kJ/mol,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低,故答案为:△H<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低;
②在体积为1L的密闭容器中,充入1molCO2和2.5molH2,发生反应,250℃时,二氧化碳的平衡转化率50%,
2CO2(g)+6H2(g)C2H4(g)+4H2O(g)
起始量(mol/L) 1 2.5span> 0 0
变化量(mol/L) 0.51.5 0.25 1
平衡量(mol/L) 0.51 0.25 1
K=![]() =1,故答案为:1。
=1,故答案为:1。

 名校课堂系列答案
名校课堂系列答案